![]()
Die Tür zu den Krebszellen schließen
Brustkrebs ist eine der häufigsten Tumorarten, und die Metastasierung erhöht das Risiko, an dieser Krankheit zu sterben, erheblich. Durch die Untersuchung des Prozesses der Intravasation oder des Eintritts von Zellen in das Gefäßsystem entdeckten Karagiannis et al., dass eine Chemotherapie nicht nur Tumorzellen abtötet, sondern auch die Intravasation verstärken kann. Zellgruppen, die als Tumormikroumgebung der Metastasierung (TMEM) bezeichnet werden, können als Eintrittspforte für Tumorzellen in das Blutgefäßsystem dienen, und die Autoren entdeckten, dass verschiedene Arten von Chemotherapie die Menge an TMEM-Komplexen und zirkulierenden Tumorzellen im Blutkreislauf erhöhen können. Die Forscher stellten auch fest, dass ein Medikament namens Rebastinib die TMEM-Aktivität beeinträchtigen und dazu beitragen kann, das erhöhte Risiko der Verbreitung von Krebszellen zu überwinden.
Zusammenfassung
Brustkrebszellen verbreiten sich über TIE2/MENACalc/MENAINV-abhängige Krebszell-Intravasionsstellen, die als Tumormikroumgebung der Metastasierung (TMEM) bezeichnet werden und klinisch als prognostische Marker der Metastasierung bei Brustkrebspatientinnen validiert sind. Anhand von fixiertem Gewebe und intravitaler Bildgebung eines PyMT-Mausmodells und von Xenotransplantaten von Patientinnen zeigen wir, dass Chemotherapie die Dichte und Aktivität von TMEM-Stellen und die Mena-Expression erhöht und die Fernmetastasierung fördert. Darüber hinaus waren in den restlichen Brustkrebszellen von Patientinnen, die mit neoadjuvantem Paclitaxel nach Doxorubicin plus Cyclophosphamid behandelt wurden, sowohl der TMEM-Score als auch das mechanistisch damit verbundene Expressionsmuster der MENAINV-Isoform erhöht, was darauf hindeutet, dass die Chemotherapie trotz abnehmender Tumorgröße das Risiko der Metastasenausbreitung erhöht. Die durch die Chemotherapie ausgelöste TMEM-Aktivität und die Verbreitung von Krebszellen wurden entweder durch die Verabreichung des TIE2-Inhibitors Rebastinib oder durch die Unterdrückung des MENA-Gens rückgängig gemacht. Unsere Ergebnisse deuten darauf hin, dass der TMEM-Score ansteigt und sich das Expressionsmuster der MENA-Isoform mit der Chemotherapie verändert und zur Vorhersage von prometastatischen Veränderungen als Reaktion auf die Chemotherapie verwendet werden kann. Darüber hinaus könnten Inhibitoren der TMEM-Funktion den klinischen Nutzen der Chemotherapie in der neoadjuvanten Phase oder bei metastasierter Erkrankung verbessern.
EINLEITUNG
Die Intravasation und Verbreitung von Brustkrebszellen erfolgt in mikroanatomischen Strukturen, die als Tumormikroumgebung der Metastasierung (TMEM) bezeichnet werden. Jedes TMEM besteht aus drei verschiedenen Zelltypen, die in direktem physischen Kontakt stehen: einer Tumorzelle, die das Aktin-regulierende Protein Mammalian-enabled (MENA) exprimiert, einem perivaskulären Makrophagen und einer Endothelzelle (1, 2). TMEM-Stellen wurden in Maus- und menschlichen Mammakarzinomen identifiziert, und ihre Dichte korreliert mit dem Metastasierungserfolg bei Brustkrebspatientinnen (3-5). Die hochauflösende intravitale Bildgebung (IVI) von primären Brusttumoren bei Mäusen hat gezeigt, dass TMEM-Stellen eine lokale und vorübergehende Dissoziation von Endothelzellverbindungen hervorrufen, durch die wandernde Krebszellen intravasieren und sich in sekundäre Bereiche ausbreiten können (1). Die TMEM-abhängige Gefäßpermeabilität ist lokal begrenzt und wird durch die Freisetzung des vaskulären endothelialen Wachstumsfaktors A (VEGF-A) aus den TMEM-gebundenen Makrophagen vermittelt, die den Angiopoietin-Rezeptor TIE2 exprimieren (1).
Randomisierte prospektive Studien zeigen, dass die Zugabe von Paclitaxel zur präoperativen neoadjuvanten Chemotherapie (NAC) die Rate des pathologischen vollständigen Ansprechens (pCR) erhöht, aber paradoxerweise das Gesamtüberleben nicht verbessert (6, 7). Es hat sich auch gezeigt, dass Taxan-basierte Chemotherapien das erneute Wachstum des Tumors fördern, indem sie die Angiogenese induzieren. Insbesondere mobilisieren sie aus dem Knochenmark stammende mesenchymale und endotheliale Progenitoren und CD11b+ myeloische Zellen, einschließlich TIE2+ Monozyten, in die Mikroumgebung des Primärtumors (8-13). TIE2+ Monozytenvorläufer verwandeln sich in TIE2hi-Makrophagen, die sich mit neu gebildeten Tumorblutgefäßen verbinden und das Tumorwachstum fördern (14, 15). Wie bereits erwähnt, sind TIE2hi-Makrophagen auch ein wichtiger Bestandteil der funktionellen TMEM-Stellen, wo sie die VEGF-A-induzierte Blutgefäßpermeabilität und die Intravasation von Tumorzellen vermitteln.
Die TMEM-abhängige Gefäßpermeabilität ist für die Intravasation von Tumorzellen zwar notwendig, aber nicht ausreichend, da für die Intravasion auch das Vorhandensein von diskohäsiven, wandernden Krebszellen erforderlich ist (1, 16-18). Diese wandernden Zellen exprimieren relativ große Mengen invasiver, chemotaktischer, prometastatischer MENA-Isoformen (19), wie z. B. die MENAINV-Isoform, und relativ geringe Mengen der antimetastatischen MENA-Isoform, MENA11a (18-26). Die MENAINV-Expression wird in invasiven Tumorzellen durch NOTCH-vermittelte Makrophagenkontakte und -signale aktiviert (27). Da Paclitaxel einen Zustrom von Makrophagen in den Primärtumor auslöst und diese für den Aufbau und die Funktion von TMEM erforderlich sind (1, 2, 20, 21, 28, 29), stellten wir die Hypothese auf, dass eine präoperative Chemotherapie die Dichte und die Aktivität von TMEM-Stellen sowie die Expression von invasionsfördernden MENA-Isoformen innerhalb des Primärtumors erhöhen und folglich die Ausbreitung von Krebszellen und die Fernmetastasierung induzieren könnte, während gleichzeitig die Krebslast reduziert wird. Eine solche Nebenwirkung würde den klinischen Nutzen von NAC schmälern und müsste durch Hemmstoffe der TMEM-Funktion blockiert werden. Hier haben wir diese Hypothese anhand von fixiertem Gewebe und IVI von Maus-Mammatumor-Virus-Polyom-Mittel-T-Antigen (MMTV-PyMT) Mausmodellen und von Patienten abgeleiteten Xenotransplantaten (PDXs) sowie von Brustkrebsgewebeproben von menschlichen Patienten vor und nach NAC (Paclitaxel gefolgt von Doxorubicin plus Cyclophosphamid) getestet.
ERGEBNISSE
Paclitaxel verzögert das Tumorwachstum, erhöht aber die Bildung von TMEM bei Brustkrebs
Da die Chemotherapie die Rekrutierung von Endothelvorläuferzellen und TIE2+ Monozytenvorläuferzellen in den Tumor induziert (10, 11, 30) und wir zuvor gezeigt haben, dass TIE2hi-Makrophagen für die TMEM-vermittelte Intravasation von Krebszellen erforderlich sind (1), untersuchten wir die Möglichkeit, dass neoadjuvantes Paclitaxel die TMEM-Assemblierung und die Verbreitung von Krebszellen und Metastasen fördert. Wir untersuchten diese Hypothese in den folgenden Brustkrebsmodellen: (i) transgene MMTV-PyMT-Mäuse mit spontanen Brusttumoren, (ii) Friend Virus B (FVB) Mäuse, die orthotop mit Tumoren von MMTV-PyMT-Spendern transplantiert wurden, und (iii) zwei PDX-Modelle, HT17 und HT33, die zuvor in unserem Labor entwickelt wurden (31). Die Tiere wurden alle 5 Tage mit Paclitaxel (10 mg/kg) behandelt, insgesamt dreimal (Abb. 1A). Die Anzahl der Tiere pro Gruppe ist in Abb. 1B dargestellt. Nach der Tötung der Tiere wurden das Tumorwachstum, die Rekrutierung von TIE2hi-Makrophagen und der Aufbau von TMEM untersucht. Die Behandlung aller Gruppen begann im frühen Karzinomstadium (Tumorgröße von ~0,3 cm Durchmesser), als nur eine minimale oder gar keine Nekrose vorhanden war (Abb. S1). Wir haben uns für die Arbeit mit dem PyMT-Maus-Mammakarzinom-Modell im Frühstadium entschieden, weil es klinisch relevante Szenarien besser widerspiegelt, bei denen die meisten Frauen mit kleinen Tumoren von <2 cm auftreten (32). Am Ende der Behandlung wurden alle Tumore histologisch als invasive Karzinome eingestuft (Abb. S1). Obwohl mit Paclitaxel behandelte Tumoren ein verzögertes Tumorwachstum zeigten (Abb. 1C), wiesen sie im Vergleich zu unbehandelten Kontrollen in allen Versuchsmodellen einen zwei- bis dreifach höheren TMEM-Score (P < 0,001) auf (Abb. 1, D und E).
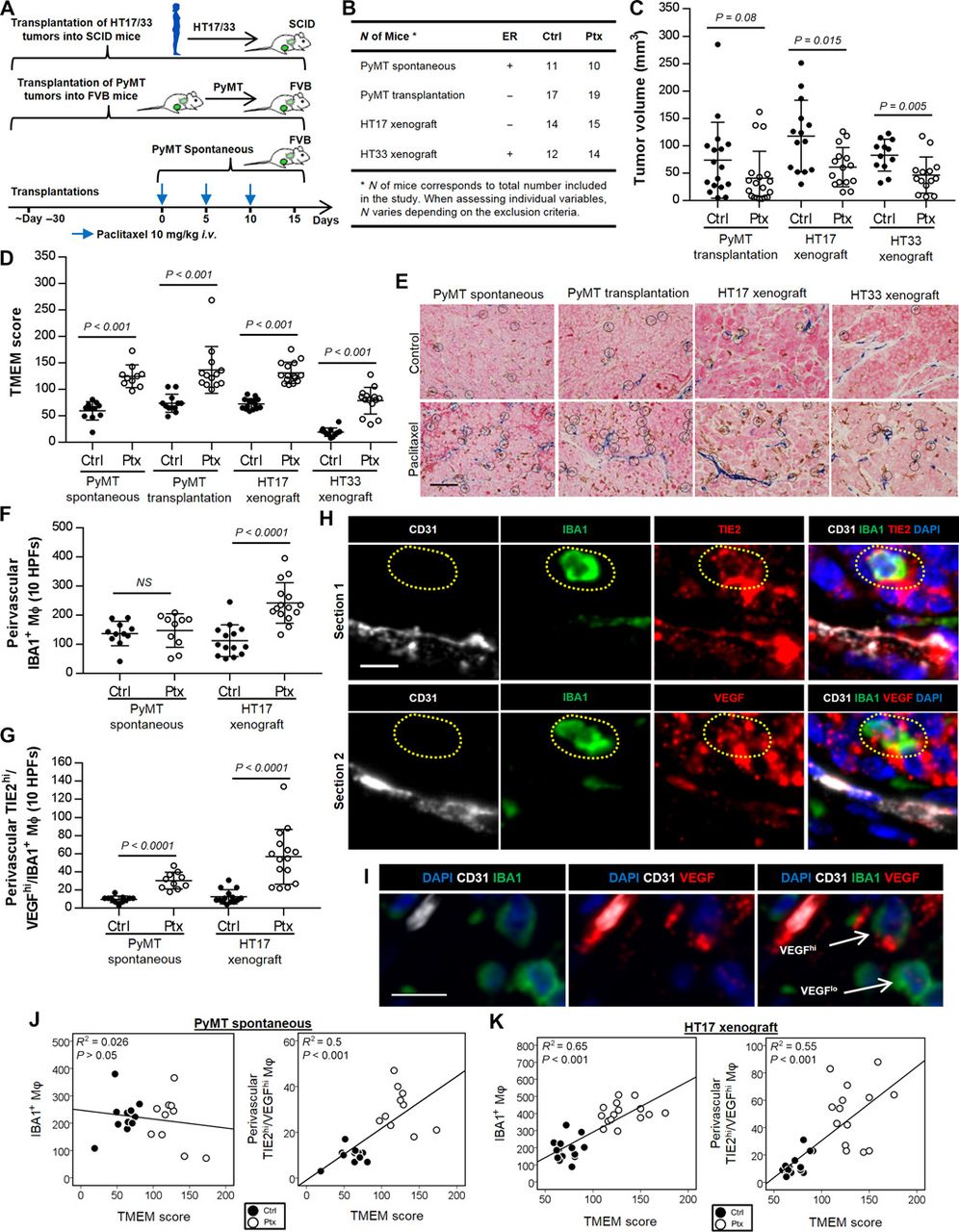
Abb. 1. Paclitaxel verzögert das Tumorwachstum und fördert die Infiltration von TIE2hi/VEGFhi-Makrophagen und den Aufbau von TMEM.
(A) Versuchsaufbau und Chemotherapie-Schema. i.v., intravenös. (B) Mausmodelle des Mammakarzinoms, Östrogenrezeptor (ER)-Status in jedem Modell und Kohortengröße. (C) Quantifizierung des Tumorvolumens am Tag 15 des in (A) gezeigten Chemotherapieschemas. Mann-Whitney-U-Test. (D) TMEM-Score, bewertet in 10 High-Power-Fields (HPFs) durch zwei Pathologen, bei Mäusen, die wie in (A) behandelt wurden. Mann-Whitney-U-Test. (E) TMEM-Identifizierung durch Dreifach-Immunhistochemie (IHC) und repräsentative Bilder für jedes Mausmodell. Maßstabsbalken, 50 μm. (F) Perivaskuläre IBA1+ Makrophagen (Mϕ) in 10 HPFs (absolute Anzahl) in PyMT Spontan- und HT17 Xenograft-Tumoren, behandelt mit Paclitaxel oder Vehikelkontrolle. Mann-Whitney-U-Test. (G) Quantifizierung der perivaskulären TIE2hi/VEGFhi-Makrophagen in 10 HPFs (absolute Anzahl) in spontanen PyMT- und HT17-Xenograft-Tumoren, die mit Paclitaxel oder einer Vehikelkontrolle behandelt wurden. Mann-Whitney-U-Test. (H) Mehrkanal-IF von IBA1, CD31, TIE2, VEGF und 4′,6-Diamidino-2-Phenylindol (DAPI) in zwei aufeinanderfolgenden Schnitten eines nicht mit Paclitaxel behandelten MMTV-PyMT-Brusttumors. Ein repräsentativer VEGFhi/TIE2hi-Makrophage (der auch IBA1 mitexprimiert) ist mit einer gelb gepunkteten Linie umrandet. Maßstabsbalken, 10 μm. (I) Mehrkanal-IF von IBA1, CD31, VEGF und DAPI in einem mit Paclitaxel behandelten HT17-Xenograft-Tumor, der einen VEGFhi und einen VEGFlo-Makrophagen in einem Feld zeigt. Skalenbalken, 15 μm. (J und K) Korrelationen der Makrophageninfiltration (IBA1+-Makrophagen oder VEGFhi/TIE2hi-Makrophagen) mit dem TMEM-Score in den PyMT-Spontan- (J) und HT17-Xenograft-Modellen (K). R2 = Pearson-Bestimmungskoeffizient; gefüllte Kreise, Kontrolle; offene Kreise, Paclitaxel.
Paclitaxel erhöht die Infiltration von perivaskulären TIE2hi/VEGFhi-Makrophagen in der Mikroumgebung von primärem Brustkrebs
Um den Mechanismus der erhöhten TMEM-Zusammensetzung bei der Verabreichung von Chemotherapie in Brusttumoren zu erklären, untersuchten wir, ob Paclitaxel die intratumorale Makrophagendichte beeinflusst, wie zuvor vermutet. Wir fanden einen signifikanten Anstieg (P < 0,01) des prozentualen Anteils der makrophagen-spezifischen IBA1+-Fläche in Paclitaxel-behandelten Mäusen in allen Transplantationsmodellen, nicht aber im PyMT-Spontanmodell (Abb. S2A). Dementsprechend war die absolute Zahl der IBA1+-Zellen in dem mit Paclitaxel behandelten HT17-Xenotransplantat signifikant erhöht (P < 0,001), nicht aber im PyMT-Spontanmodell, wenn man sie entweder über das gesamte Gewebe (Abb. S2B) oder nur in der perivaskulären Nische (Abb. 1F), in der sich TMEM-Strukturen befinden, quantifiziert.
Die funktionellen TMEM-Stellen enthalten TIE2hi/VEGFhi-Makrophagen und invasive Tumorzellen in perivaskulären Regionen (1), und die Chemotherapie kann die Mobilisierung solcher TIE2hi-Monozytenvorläufer in Primärtumoren fördern (8, 10). Daher konzentrierten wir uns auf die TIE2hi/VEGFhi-Makrophagen-Subpopulation und quantifizierten sie mit Hilfe der Mehrkanal-Immunfluoreszenz (IF)-Bildgebung (Abb. 1, G bis I, und Abb. S2C) (10, 14, 34). Paclitaxel-behandelte Mäuse hatten eine signifikant höhere (P < 0,001) Dichte an TIE2hi/VEGFhi-Makrophagen im Vergleich zu den mit Vehikel behandelten Kontrollen, unabhängig davon, ob diese im gesamten Gewebe (Abb. S2D) oder nur in den perivaskulären Nischen (Abb. 1G) untersucht wurden. Der Anteil der TIE2hi/VEGFhi-Makrophagen an allen IBA1+-Zellen wurde durch die Paclitaxel-Behandlung ebenfalls erhöht (Abb. S2, E und F). Die signifikante Zunahme der perivaskulären TIE2hi/VEGFhi-Makrophagen-Subpopulation (P < 0,0001) wurde auch im PyMT-Spontanmodell nachgewiesen (Abb. 1G und Abb. S2F). Abbildung 1H zeigt ein repräsentatives IF-Bild eines TIE2hi/VEGFhi-Makrophagen, der anhand von CD31-, IBA1-, VEGF- und TIE2-Färbung quantifiziert wurde. Abbildung 1I zeigt ein repräsentatives Beispiel von VEGFhi– und VEGFlo-Makrophagen, die im gleichen Sichtfeld durch die Kombination von CD31-, IBA1- und VEGF-Färbung vergleichbar sind.
Im PyMT-Spontanmodell korrelierte die Gesamtzahl der IBA1+-Makrophagen nicht mit dem TMEM-Score (Abb. 1J, linkes Feld), aber wir fanden eine Korrelation (P < 0,001) von TMEM mit perivaskulären TIE2hi/VEGFhi-Makrophagen (R2 = 0,5) (Abb. 1J, rechtes Feld). Im HT17-Xenotransplantat korrelierten sowohl die gesamten IBA1+-Makrophagen (Abb. 1K, linkes Feld) als auch die perivaskulären TIE2hi/VEGFhi-Makrophagen (Abb. 1K, rechtes Feld) mit dem TMEM-Score (R2 = 0,65 bzw. R2 = 0,55) (P < 0,001 in beiden Fällen). Sowohl der TMEM-Score als auch die perivaskulären TIE2hi/VEGFhi-Makrophagen blieben nach der Chemotherapie erhöht, auch nachdem ihre Werte auf die mikrovaskuläre Dichte normalisiert worden waren (Abb. S3, A bis C). Insgesamt fördert neoadjuvantes Paclitaxel spezifisch den Aufbau von TMEM-Stellen mit TIE2hi/VEGFhi-Makrophagen, die für die TMEM-Aktivität bei primärem Brustkrebs erforderlich sind.
Paclitaxel induziert TMEM-abhängige Gefäßdurchlässigkeit in Brusttumoren
Da eine Chemotherapie die Blutgefäßdynamik durch Induktion der Angiogenese beeinflussen kann (9, 11-13, 35-37), haben wir IVI (Abb. 2, A und B, und Abb. S4A) verwendet, um zu untersuchen, ob neoadjuvantes Paclitaxel TMEM-abhängige (lokalisierte) oder TMEM-unabhängige (allgemeinere) Blutgefäßleckagen induziert. Tumore in Mäusen, die mit Paclitaxel behandelt wurden, zeigten keinen allgemeinen Blutgefäßaustritt von Tetramethylrhodamin (TMR)-konjugiertem 155-kDa-Dextran im extravaskulären Teil der Tumore. Stattdessen zeigten sie örtlich begrenzte Bereiche mit vorübergehender Gefäßpermeabilität, die als „Bursting“ bezeichnet wird (Abb. 2C und Videos S1 und S2), ähnlich denen, die zuvor bei unbehandelten Tumoren beobachtet wurden (1). Abb. 2C zeigt ein charakteristisches Beispiel für die Spitzenwerte der Bursting-Aktivität (Standbild links in Abb. 2C; Zeitraffer in Video S1) an einer TMEM-Stelle, obwohl nicht alle TMEM-Stellen Bursting-Aktivität aufwiesen (Standbild rechts in Abb. 2C; Zeitraffer in Video S3). Alle Ausbrüche traten nur an TMEM-Stellen auf, in unmittelbarer Nähe zu mindestens einer Dendra2+ Tumorzelle und einem CFP+ Makrophagen (Abb. 2C, linkes Bild). Wie bereits früher berichtet (1), konnten wir keine Ausbrüche beobachten, die nicht in unmittelbarer Nähe einer klar definierten TMEM-Stelle auftraten. Bursting wurde durch die Anhäufung von Dextran-TMR-Signalen im Laufe der Zeit um eine aktive TMEM-Stelle dokumentiert, und es wurde keine solche Anhäufung abseits von TMEM beobachtet (Abb. 2D). Die Intensitätswerte aller TMEM-vermittelten Bursting-Ereignisse, die in Paclitaxel-behandelten Mäusen beobachtet wurden, wurden gemittelt und über die gesamte Zeit der Bursting-Aktivität aufgetragen (Abb. S4B), was die vorübergehende Natur der Paclitaxel-induzierten, TMEM-abhängigen Gefäßpermeabilität bestätigte.
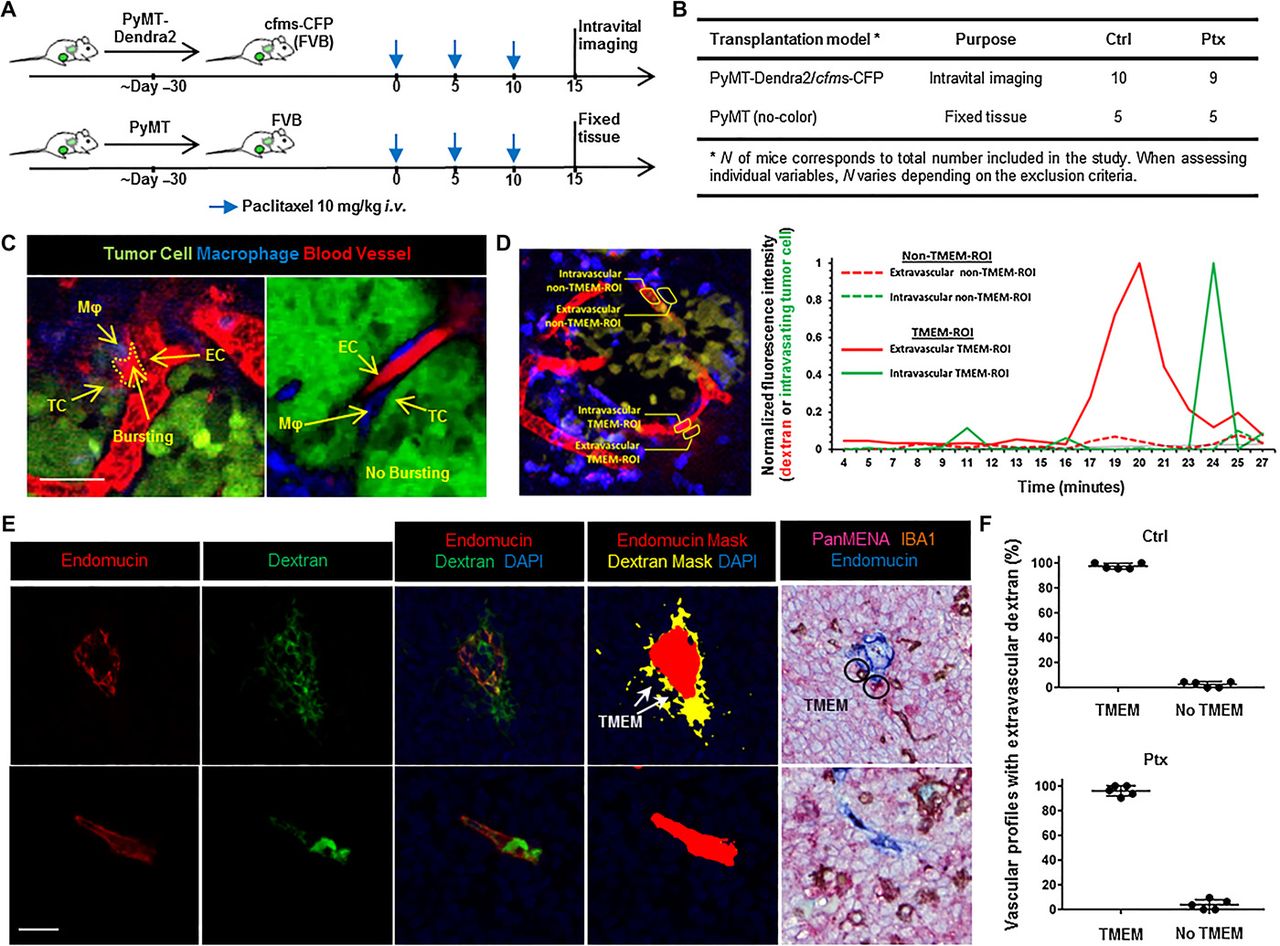
Abb. 2. Paclitaxel induziert die Gefäßpermeabilität ausschließlich an TMEM-Stellen.
(A) Versuchsaufbau und Chemotherapie-Schema. (B) Mausmodelle des Mammakarzinoms und Kohortengrößen. (C) Zwei Beispiele von Bildern aus der IVI von cfms-CFP-Mäusen, die mit MMTV-PyMT/Dendra2+-Tumoren transplantiert wurden. Linkes Bild: Bursting am TMEM (TMEM-Aktivität), erkennbar an der Anwesenheit von TMR-konjugiertem 155-kDa-Dextran im extravaskulären Raum. Der Umriss des Ausbruchs ist durch die gestrichelte gelbe Linie gekennzeichnet. Rechtes Bild: Abwesenheit von Bursting bei TMEM, als Kontrolle. Mφ, Makrophage; TC, Tumorzelle; EC, Endothelzelle. Maßstabsbalken, 25 μm. (D) Linkes Bild: Auswahl der Region von Interesse (ROI) für die Berechnung der Dendra2/TMR-Signalintensität im Zeitverlauf. Rechte Grafik: Quantifizierung der Signalintensität von extravaskulärem Dextran (rote Linien) und Dendra2-markierten intravasierenden Krebszellen (grüne Linien) in den ausgewählten TMEM-assoziierten (durchgezogene Linien) bzw. nicht-TMEM-assoziierten (gepunktete Linien) ROIs aus dem links dargestellten Bild. (E) Mehrkanal-IF von Endomucin (erste Spalte), Dextran-TMR (zweite Spalte), ihr zusammengeführtes Bild zusammen mit DAPI (dritte Spalte), die entsprechenden mit Schwellenwerten versehenen Blutgefäß- und extravaskulären Dextranmasken (vierte Spalte) und der entsprechende sequenzielle Abschnitt der TMEM-IHC (fünfte Spalte) in MMTV-PyMT-Mäusen, die mit Paclitaxel behandelt wurden. Obere Reihe: TMEM-assoziiertes vaskuläres Profil. Untere Reihe: Vaskuläres Profil abseits von TMEM. Maßstabsbalken, 20 μm. (F) Prozentualer Anteil der Gefäßprofile mit extravaskulärem Dextran, die mindestens eine TMEM-Stelle oder keine TMEM-Stellen aufweisen, für mit Vehikel behandelte (oberes Diagramm) oder mit Paclitaxel behandelte (unteres Diagramm) Fälle.
Um explizit zu zeigen, dass die Intravasion von Tumorzellen nach einer Paclitaxel-Behandlung von TMEM-abhängigem Bursting abhängt, haben wir die tumorzellspezifische Dendra2-Signalintensität in Blutgefäß-ROIs gemessen, die direkt neben oder entfernt von Bursting-Stellen lagen (Abb. 2D). Die gesamte Zeitrafferaufnahme dieses Bereichs ist in Video S2 zu sehen. Die Signalintensität von Dextran-TMR wurde auch in den entsprechenden extravaskulären ROIs quantifiziert, um das Vorhandensein von Bursting zu bestätigen. Wir fanden heraus, dass die Intravasion von Krebszellen in mit Paclitaxel behandelten Tieren während oder kurz nach dem Bursting-Ereignis auftritt, und zwar speziell an TMEM-Stellen, die mit dem Bursting verbunden sind, aber nie vor dem Bursting-Ereignis oder an TMEM-Stellen ohne Bursting-Aktivität (Abb. 2D).
In einem unabhängigen Validierungsexperiment erhielt eine Gruppe von mit Vehikel oder Paclitaxel behandelten Mäusen eine Stunde lang eine intravenöse Injektion von Dextran-TMR und wurde dann geopfert und auf vaskuläre Permeabilität in fixierten Tumorschnitten untersucht. Die Mehrkanal-IF-Färbung umfasste Endomucin als Ausschlussmaske für Blutgefäße und einen Anti-TMR-Antikörper zur Bewertung der Dextran-Leckage (Abb. S5). Ein entsprechender TMEM IHC-Färbungsschnitt wurde mit dem Schnitt abgeglichen, um das Vorhandensein bzw. Nichtvorhandensein von TMEM in jedem Gefäßprofil mit Gefäßleckagen zu bewerten. Die obere Reihe zeigt ein vaskuläres Profil mit reichlich extravaskulärem Dextran, das mit zwei TMEM-Stellen kolokalisierte, während die untere Reihe ein vaskuläres Profil mit fehlendem oder minimalem extravaskulärem Dextran zeigt, das mit einem Blutgefäß ohne TMEM kolokalisierte (Abb. 2E). Für die Quantifizierung wurden für jede Maus etwa 20 bis 30 Gefäßprofile ausgewählt, je nach Gewebegröße, Grad der Vaskularisierung und Qualität der Endomucinfärbung. Sowohl in den mit Vehikel als auch in den mit Paclitaxel behandelten Gruppen kolokalisierten etwa 96 bis 98 % der vaskulären Profile mit extravaskulärem Dextran mit mindestens einem TMEM (Abb. 2F).
Paclitaxel steigert die Metastasenausbreitung von Brusttumoren
Um festzustellen, ob die Behandlung mit Paclitaxel die Verbreitung von Tumorzellen und das Auftreten von Metastasen fördert, haben wir zunächst die IVI verwendet, um das Auftreten und die Häufigkeit von Ausbrüchen bei Mäusen zu quantifizieren und zu vergleichen, die mit Vehikel oder Paclitaxel behandelt wurden (Abb. 3, A bis C, und Videos S1 und S3). Die Inzidenz (mindestens ein Bursting-Ereignis in einer ~4,5-stündigen Bildgebungssitzung) und die Häufigkeit von Bursting waren bei den mit Paclitaxel behandelten Mäusen im Vergleich zu den mit der Vehikelkontrolle behandelten Tieren erhöht (Abb. 3, B und C). Zu den gleichen Schlussfolgerungen gelangte man, wenn die Häufigkeit der Ausbrüche auf die Anzahl der TMEM-Stellen in den einzelnen Feldern normiert wurde (Abb. S6, A und B). Im Gegensatz zu Tumoren im Spätstadium, bei denen TMEM spontane Aktivität zeigt, wie wir bereits berichtet haben (1), ist TMEM-assoziiertes Bursting ein sehr seltenes Phänomen bei Frühkarzinomenen (Abb. 3C). Zusätzlich zur IVI quantifizierten und verglichen wir die extravaskuläre Dextranfläche als Prozentsatz normalisiert auf die Blutgefäßfläche in fixierten Tumoren von Mäusen, die entweder mit Vehikel oder Paclitaxel behandelt wurden, unter Verwendung von Mehrkanal-IF (Abb. 3, D und E, und Abb. S5). Extravaskuläres Dextran war in mit Paclitaxel behandelten Mäusen etwa dreimal so häufig (P < 0,05) wie in mit dem Vehikel behandelten Mäusen (Abb. 3, D und E).

Abb. 3. Paclitaxel fördert die TMEM-abhängige Gefäßpermeabilität, die Ausbreitung von Krebszellen und die Metastasierung bei Brustkrebs.
(A) Zeitrafferaufnahmen aus den Videos S1 (obere Reihe) und S3 (untere Reihe). Die Zeit ist in Minuten angegeben (t = 0 bis 20 min). Obere Reihe: Die Pfeilspitze zeigt den Ort des Ausbruchs eines aktiven TMEM in einer mit Paclitaxel behandelten Maus. Untere Reihe: Die Pfeilspitze markiert das Fehlen des Ausbruchs aus einem inaktiven TMEM in einer mit Paclitaxel behandelten Maus. Maßstabsbalken, 50 μm. (B) Häufigkeit von Bursting (mindestens ein vollständiges Ereignis während ~4,5 Stunden Bildgebung pro Maus) bei Paclitaxel- und Vehikel-behandelten MMTV-PyMT/Dendra2 cfms-CFP-Mäusen. (C) Häufigkeit von Bursts bei Paclitaxel- und MMTV-PyMT/Dendra2 cfms-CFP Kontrollmäusen. Mann-Whitney-U-Test. (D) Repräsentative Blutgefäß- (Endomucin) und extravaskuläre Dextranmasken, erhalten durch IF in Mäusen, die entweder mit Vehikel oder Paclitaxel behandelt wurden, zeigen die TMEM-assoziierte Gefäßpermeabilität (gelber Bereich). Maßstabsbalken, 100 μm. (E) Quantifizierung der extravaskulären Dextranfläche, normalisiert auf die Blutgefäßfläche bei Mäusen, die entweder mit Vehikel oder Paclitaxel behandelt wurden, wie in (D) dargestellt. Mann-Whitney-U-Test. (F) CTCs pro Milliliter Blut, das vor der Tötung (Tag 15) gesammelt wurde. Die Werte wurden jeweils auf die Kontrollgruppe normalisiert, um die Variabilität zwischen den Kohorten zu berücksichtigen. Mann-Whitney-U-Test. (G) Korrelation zwischen CTCs und TMEM. R2 = Pearson-Bestimmungskoeffizient; gefüllte Kreise, Kontrolle; offene Kreise, Paclitaxel. (H) Nachweis von mikrometastatischen Herden in der Lunge von Paclitaxel-treaten. Abgebildet sind zwei Fälle von histologisch nachweisbaren Metastasen in der Lunge von PyMT-Transplantaten bzw. HT17-Xenografts. Maßstabsbalken, 100 μm. (I) Auftreten von Lungenmetastasen bei Mäusen, die mit Paclitaxel oder einer Vehikelkontrolle behandelt wurden, χ2-Test. (J) Quantifizierung der histologisch nachweisbaren Lungenmetastasen bei Mäusen, die mit Paclitaxel oder der Vehikelkontrolle behandelt wurden. Mann-Whitney-U-Test. (K) Stereomikroskopie in der extrahierten Mauslunge. Blutgefäße, die durch Injektion von Rhodamin-markiertem Lektin in die Schwanzvene 1 Stunde vor der Tötung sichtbar gemacht wurden, und Krebszellen, die durch Dendra2-Expression identifiziert wurden (Pfeil). Mann-Whitney-U-Test. Maßstabsbalken, 20 μm. (L) Quantifizierung der Ausbreitung einzelner Krebszellen in der Lunge von PyMT-Transplantaten mittels Fluoreszenz-Stereomikroskopie. Mann-Whitney-U-Test.
Nachdem wir gezeigt hatten, dass die TMEM-Funktion mit der Intravasation von Tumorzellen in chemotherapeutisch behandelten Tumoren verbunden ist (Abb. 2D), stellten wir die Frage, ob eine Paclitaxel-Behandlung zu einer verstärkten metastatischen Verbreitung von Brustkrebszellen führt. Wir fanden eine etwa zweifache Zunahme der zirkulierenden Tumorzellen (CTCs) (P < 0,05) nach einer Paclitaxel-Behandlung in allen untersuchten experimentellen Modellen (Abb. 3F). Der TMEM-Score und die CTCs korrelierten positiv im PyMT-Spontanmodell (R2 = 0,57, P < 0,001), im PyMT-Transplantationsmodell (R2 = 0,63, P < 0,001) sowie in den PDX-Modellen HT17 (R2 = 0,28, P < 0,05) und HT33 (R2 = 0,28, P < 0,05), obwohl die Korrelationen in den Xenografts HT17 und HT33 schwächer waren (Abb. 3G). Da die in den PDX-Modellen verwendeten Mäuse mit schwerer kombinierter Immunschwäche (SCID) so konstruiert sind, dass sie die adaptive Immunität verlieren, aber die angeborene Immunität beibehalten, ist es möglich, dass die schwächeren Korrelationen auf ein unterschiedliches Ausmaß der immunvermittelten Abstoßung von CTCs zurückzuführen sind.
Um die Wirkung von Paclitaxel auf die Ausbreitung von Krebszellen in entfernte Gebiete weiter zu bestimmen, entnahmen wir Lungen und untersuchten metastatische Herde histologisch (Abb. 3H und Abb. S5). Wir fanden einen Anstieg sowohl der Metastaseninzidenz (mindestens ein mikrometastischer Herd mit mehr als fünf Tumorzellen) (Abb. 3I) als auch der Anzahl der Krebszell-Mikrometastasen in den Lungen der mit Paclitaxel behandelten Mäuse (Abb. 3J). Darüber hinaus quantifizierten wir die Einzelzellverbreitung von Brustkrebszellen in der Lunge von FVB-Empfängermäusen nach syngener Transplantation von MMTV-PyMT/Dendra2+-Tumoren mit Hilfe der Ex-vivo-Mikroskopie (Abb. 3K und Abb. S5) und fanden eine etwa zweifache Zunahme (P < 0,01) einzelner Dendra2+-Brustkrebszellen in der Lunge von Paclitaxel-behandelten Mäusen (Abb. 3L). Insgesamt deuten diese Daten darauf hin, dass die Chemotherapie bei Brustkrebs im Frühstadium die Gefäßpermeabilität an TMEM-Stellen erhöht, was mit einer verstärkten Ausbreitung der Krebszellen einhergeht.
Paclitaxel fördert die Expression der invasiven Isoformen von Mena in Brusttumoren
Da unsere Daten zeigten, dass eine Paclitaxel-Behandlung die TMEM-Assemblierung sowie die TMEM-abhängige vaskuläre Permeabilität und die metastatische Ausbreitung erhöht, stellten wir die Hypothese auf, dass sie auch den Anteil hochmigrativer Krebszellen erhöht, die invasive Isoformen des Aktin-regulierenden Proteins MENA (21, 23) exprimieren und in der Lage sind, TMEM-Stellen zu assemblieren und für die Intravasation zu nutzen – eine wichtige Voraussetzung für eine erfolgreiche metastatische Aussaat. Um diese Hypothese zu testen, führten wir zunächst eine quantitative Reverse-Transkriptions-Polymerase-Kettenreaktion (qRT-PCR) für Gesamt-MENA (PanMena), Mena11a und MenaINV an formalinfixierten, in Paraffin eingebetteten (FFPE) Tumoren aus den PyMT-Spontan- und HT17-Xenograft-Modellen durch (Abb. S7A). Die Behandlung mit Paclitaxel erhöhte signifikant (P < 0,01) die Expression von PanMena, MenaINV und MENACalc, einem Marker, der das gesamte Repertoire der invasiven Mena-Isoformen einschließlich MenaINV (38, 39) berücksichtigt, nicht aber die des antimetastatischen Mena11a (Abb. 4, A bis D), und der mit einem Fernrezidiv bei Brustkrebspatientinnen korreliert (38, 39). Darüber hinaus korrelierten sowohl MENACalc als auch MenaINV in beiden getesteten Modellen positiv mit einem erhöhten TMEM-Score (MenaINV, P < 0,001; MENACalc, P < 0,01) (Abb. 4, E und F), wobei MenaINV höhere Korrelationskoeffizienten aufwies als MENACalc. Die Paclitaxel-vermittelte erhöhte MenaINV-Expression (P < 0,0001) und die Korrelation mit dem TMEM-Score (P < 0,001) wurden auch auf Proteinebene sowohl in den PyMT-Spontan- als auch in den HT17-Xenograft-Modellen bestätigt (Abb. 4, G bis I, und Abb. S7, B und C). Wie in der spezifischen MenaINV-IF gezeigt, war das Muster der MenaINV-Expression in PyMT-Mäusen heterogen (Abb. 4G und Abb. S7C), was mit früheren Beobachtungen übereinstimmt (40). Wir fanden eine positive Korrelation zwischen der TIE2hi/VEGFhi-Makrophageninfiltration und der MenaINV-Expression (P < 0,001, R2 = 0,68) (Abb. S8A) sowie MENACalc (P < 0,05, R2 = 0,24) (Abb. S8B), was die Belege dafür unterstützt, dass der direkte Kontakt der Tumorzellen mit Makrophagen die MenaINV-Expression induziert (27). Darüber hinaus gab es eine inverse Korrelation für das antimetastatische Mena11a (P < 0,01, R2 = 0,3) (Abb. S8C).
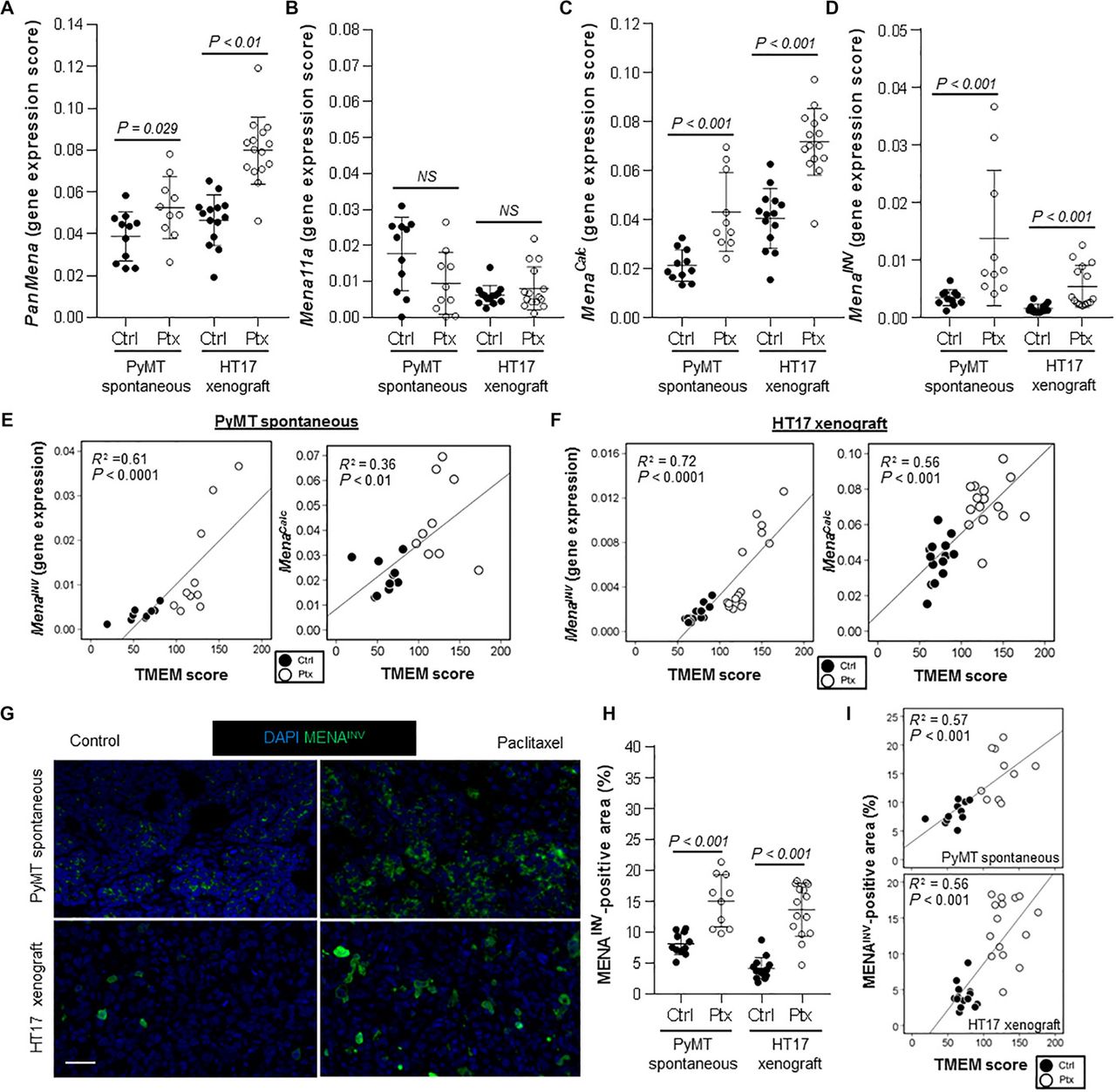
Abb. 4. Paclitaxel fördert die Expression invasiver Isoformen von MENA in der primären Mikroumgebung von Brustkrebs.
(A bis D) Genexpression von MENA oder MENA-Isoformen (Echtzeit-RT-PCR) nach RNA-Extraktion aus FFPE-Tumoren. Genexpression von Pan-Mena (A), Mena11a (B), MenaCalc (C), und MenaINV (D) angegeben. Mann-Whitney-U-Test. NS, nicht signifikant. (E und F) Korrelationen von MenaCalc mit TMEM und MenaINV-Genexpression mit TMEM in den PyMT-Spontantumoren (E) und HT17-Xenotransplantaten (F). R2 = Bestimmungskoeffizient nach Pearson; gefüllte Kreise, Kontrolle; offene Kreise, Paclitaxel. (G) MENAINV-Proteinexpression, dargestellt durch MENAINV IF und DAPI in spontanen PyMT- und HT17-Xenograft-Tumoren, die mit Paclitaxel oder einer Vehikelkontrolle behandelt wurden. Maßstabsbalken, 100 μm. (H) Quantifizierung der MENAINV-positiven Fläche (%) in den in (G) dargestellten Tumoren. Mann-Whitney-U-Test. (I) Korrelation der MENAINV-positiven Fläche (%) mit dem TMEM-Score in den PyMT-Spontan- (oberes Diagramm) und HT17-Xenograft-Modellen (unteres Diagramm). R2 = Pearson-Bestimmungskoeffizient; gefüllte Kreise, Kontrolle; offene Kreise, Paclitaxel.
Paclitaxel fördert die Verbreitung von Brustkrebszellen in einer MENA-abhängigen Weise
Tiere, die mit MMTV-PyMT MENA-null-Tumoren transplantiert wurden, entwickeln keine CTCs und Lungenmetastasen (28), was darauf hindeutet, dass MENA für die Verbreitung von Tumorzellen notwendig ist. Nachdem wir gezeigt hatten, dass Paclitaxel die TMEM-Assemblierung (Abb. 1D) und die Expression invasiver MENA-Isoformen (Abb. 4, C, D, G und H) steigert, untersuchten wir als Nächstes, ob die Paclitaxel-vermittelte Tumorzelldissemination bei invasivem Brustkrebs ebenfalls MENA-abhängig ist. Um diese Hypothese zu testen, transplantierten wir orthotopisch MENA-/- oder MENA+/+ CFP-fluoreszierende PyMT-Tumore in syngene Wildtyp-Wirte, um die Intravasation und Verbreitung von Tumorzellen in den Lungen von Mäusen nach einer Paclitaxel-Behandlung zu untersuchen (Abb. 5, A und B). MENA-/- Mäuse exprimierten kein MENAINV-Protein (Abb. S7B). Die quantitative Bewertung von Makrophagen in den perivaskulären Nischen von MENA-/- Mäusen zeigte sowohl eine erhöhte IBA1+ als auch TIE2hi/VEGFhi IBA1+ Makrophageninfiltration nach der Paclitaxel-Behandlung (Abb. 5, C bis F, und Abb. S9, A bis C), ähnlich den Veränderungen, die bei PyMT und HT17 MENA+/+ Mäusen nach der Chemotherapie beobachtet wurden (Abb. 1, F und G). Diese Ergebnisse zeigen, dass MENA die Paclitaxel-vermittelte TIE2hi/VEGFhi-Makrophagen-Rekrutierung in der primären Brusttumor-Mikroumgebung nicht beeinträchtigt.
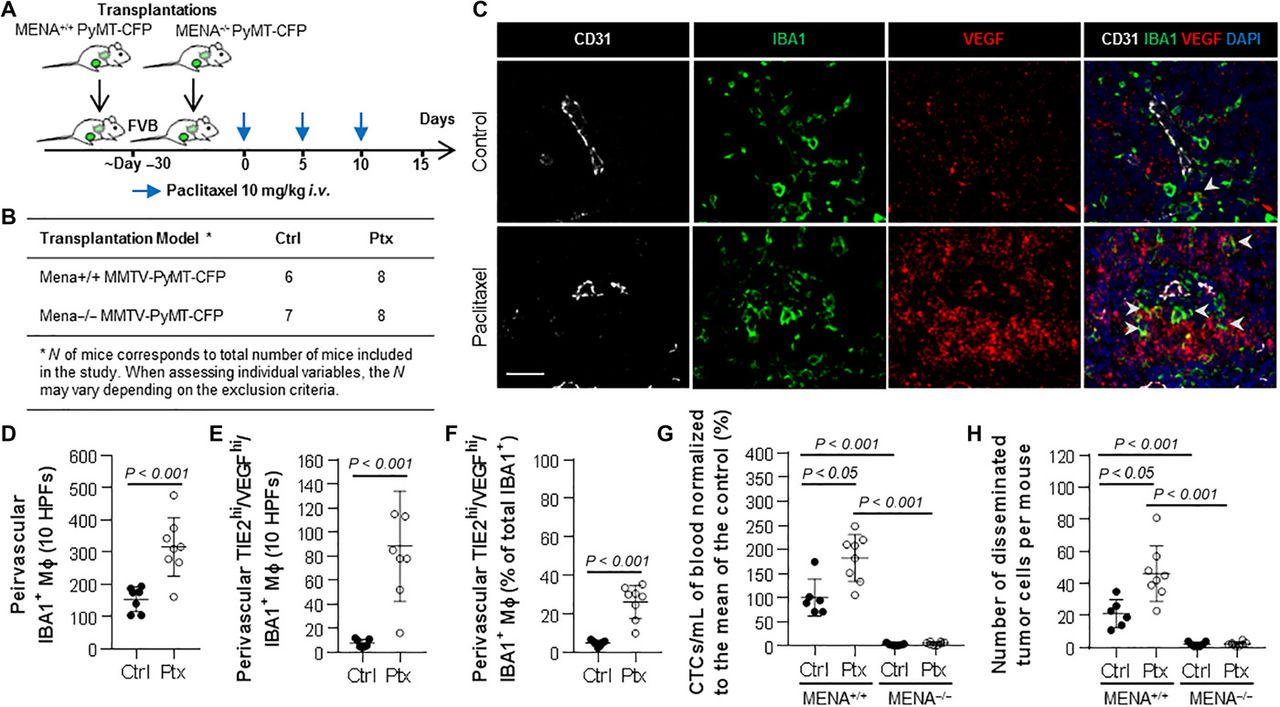
Abb. 5. Paclitaxel fördert die Verbreitung und Metastasierung von Brustkrebszellen in einer MENA-abhängigen Weise.
(A) Versuchsaufbau und Chemotherapie-Schema. (B) Mausmodelle des Mammakarzinoms und Kohortengrößen. (C) Mehrkanal-IF von IBA1, CD31, VEGF und DAPI in MENA-/- MMTV-PyMT-CFP-transplantierten Tumoren, die entweder mit einer Vehikelkontrolle (oberes Feld) oder Paclitaxel (unteres Feld) behandelt wurden. Pfeilspitzen: VEGFhi/IBA1+-Makrophagen. Maßstabsbalken, 25 μm. (D) Perivaskuläre IBA1+-Makrophagen (Mϕ), gezählt in 10 HPFs (absolute Zahlen) in MENA-/- MMTV-PyMT-CFP-transplantierten Tumoren, die mit Paclitaxel oder einer Fahrzeugkontrolle behandelt wurden. Mann-Whitney-U-Test. (E und F) Quantifizierung der perivaskulären TIE2hi/VEGFhi-Makrophagen (Mϕ) in MENA-/- MMTV-PyMT-CFP-transplantierten Tumoren, die mit Paclitaxel oder einer Vehikelkontrolle behandelt wurden. Absolute Zahlen (E) oder Prozentsätze (F) aller perivaskulären IBA1+-Makrophagen (Mϕ). Mann-Whitney-U-Test. (G) CTCs pro Milliliter Blut von MENA+/+ und MENA-/- PyMT-CFP-Mäusen. Die Werte sind jeweils auf die Kontrollgruppe normalisiert, um die Variabilität zwischen den Kohorten zu berücksichtigen. Mann-Whitney-U-Test. (H) Quantifizierung der Ausbreitung einzelner Krebszellen in den Lungen von MENA+/+ und MENA-/- PyMT-CFP-Transplantaten mittels Fluoreszenz-Stereomikroskopie. Mann-Whitney-U-Test.
Da eine MENA-exprimierende Tumorzelle eines der Elemente der dreiteiligen TMEM-Struktur darstellt, bauen MENA-/--Tumoren kein TMEM auf. Da jedoch die perivaskulären TIE2hi/VEGFhi-Makrophagen auch in den MENA-/--Tumoren durch eine Paclitaxel-Behandlung rekrutiert werden konnten (Abb. 5, E und F), untersuchten wir als Nächstes, ob diese TIE2hi/VEGFhi-Makrophagen allein ausreichen, um die Ausbreitung von Krebszellen zu erhöhen, ohne dass eine vollständige TMEM-Struktur vorhanden ist. Das Fehlen des Mena-Gens führte zu einer vollständigen Eliminierung der CTCs (P < 0,0001) und der Anzahl einzelner Krebszellen, die sich in der Lunge ausbreiteten (P < 0,0001) (Abb. 5, G und H), was mit früheren Ergebnissen übereinstimmt (28). Diese Unterdrückung war unabhängig von der Behandlung mit einem Vehikel oder Paclitaxel (Abb. 5, G und H), was darauf hindeutet, dass die Eliminierung des Mena-Gens bei Brustkrebs die Intravasation und Dissemination von Krebszellen beeinträchtigt, obwohl sie die Paclitaxel-vermittelte Zunahme der perivaskulären TIE2hi/VEGFhi-Makrophagen weiterhin ermöglicht. So führte die Behandlung mit Paclitaxel bei MENA-/- PyMT-CFP-Transplantaten nicht zu einem Anstieg der Anzahl von CTCs im Blut oder disseminierten Zellen in der Lunge, wie dies bei MENA+/+-Mäusen der Fall war (Abb. 5, G und H). Zusammenfassend zeigen diese Daten, dass die Paclitaxel-induzierte Tumorzelldissemination auch von der MENA-Expression abhängt, was die wesentliche Rolle von TMEM bei der Paclitaxel-stimulierten Tumorzelldissemination weiter unterstützt.
Die Behandlung mit Doxorubicin/Cyclophosphamid führt zu ähnlichen prometastatischen Veränderungen wie Paclitaxel in der Mikroumgebung von Brustkrebs
Nachdem wir gezeigt hatten, dass Paclitaxel in einer Vielzahl von Mausmodellen TMEM- und MENA-vermittelte prometastatische Veränderungen in der Mikroumgebung des primären Brusttumors hervorruft, untersuchten wir, ob ähnliche Wirkungen auch durch andere Chemotherapeutika hervorgerufen werden können. Wir wählten die kombinierte Chemotherapie Doxorubicin/Cyclophosphamid aus, da sie ein Hauptbestandteil der NAK bei menschlichen Brustkrebspatientinnen ist (41, 42). Transgene MMTV-PyMT-Mäuse mit spontanen Brusttumoren erhielten alle 5 Tage insgesamt drei Dosen Doxorubicin (5 mg/kg, intravenös) und eine Einzeldosis Cyclophosphamid (120 mg/kg, intraperitoneal) (Abb. 6, A und B). Bei der histologischen Untersuchung der entstandenen Tumoren waren Nekrose und Zelltod in den mit Doxorubicin/Cyclophosphamid behandelten Tumoren deutlicher zu erkennen als bei den mit dem Vehikel behandelten Mäusen (Abb. 6C). Der TMEM-Score war nach der Doxorubicin/Cyclophosphamid-Behandlung signifikant (P < 0,05) erhöht (Abb. 6, C und D) und ging mit einem signifikanten ~1,3-fachen (P = 0,027) Anstieg der Anzahl der CTCs (Abb. 6E) sowie einer erhöhten Anzahl perivaskulärer TIE2hi/VEGFhi-Makrophagen im Vergleich zu den mit Vehikel behandelten Kontrollen einher (Abb. 6F). Die Kombination von Doxorubicin und Cyclophosphamid wirkt sich also auf die TMEM-Dichte, die TMEM-Aktivität und die CTCs in ähnlicher Weise aus wie Paclitaxel, was ein weiterer Hinweis darauf ist, dass verschiedene NAC-Therapien ähnliche prometastatische Wirkungen haben können.

Abb. 6. Nicht-taxanhaltige Chemotherapien induzieren TMEM-abhängige prometastatische Veränderungen in der Mikroumgebung von Brustkrebs.
(A) Versuchsaufbau und Chemotherapieschema. (B) Mausmodelle des Mammakarzinoms und Kohortengrößen. (C) Repräsentative histologische [Hämatoxylin und Eosin (H&E); linke Spalte] und TMEM IHC-Schnitte (rechte Spalte) von MMTV-PyMT-Mäusen, die eine Doxorubicin/Cyclophosphamid-Behandlung oder eine Vehikelkontrolle erhielten, wie in (A) gezeigt. Maßstabsbalken, 50 μm. (D) TMEM-Score bei MMTV-PyMT-Mäusen, die entweder mit der Vehikelkontrolle oder mit Doxorubicin/Cyclophosphamid behandelt wurden. Mann-Whitney-U-Test. (E) CTCs pro Milliliter Blut, das vor der Tötung (Tag 15) entnommen wurde. Die Werte wurden jeweils auf die Kontrollgruppe normalisiert, um die Variabilität zwischen den Kohorten zu berücksichtigen. Mann-Whitney-U-Test. (F) Anteil der perivaskulären TIE2hi/VEGFhi-Makrophagen an allen IBA1+-Makrophagen, quantifiziert in MMTV-PyMT-Mäusen, die entweder mit Doxorubicin/Cyclophosphamid oder einer Vehikelkontrolle behandelt wurden. Mann-Whitney-U-Test.
NAC mit Paclitaxel induziert prometastatische Veränderungen in der Tumormikroumgebung von Brustkrebspatientinnen
Auf der Grundlage der in den Abbildungen 1 bis 6 dargestellten Ergebnisse haben wir unsere Untersuchungen auf menschliche Brustkrebspatientinnen ausgeweitet, die NAC mit Paclitaxel, Doxorubicin und Cyclophosphamid erhielten. Die Veränderung der TMEM-Dichte in Proben nach NAC wurde bei 20 Patientinnen mit ER+/HER2– Erkrankung untersucht, die mit wöchentlichem Paclitaxel für bis zu 12 Wochen, gefolgt von vier Zyklen Doxorubicin plus Cyclophosphamid, behandelt wurden und nach NAC eine Resterkrankung aufwiesen [residuale Krebslast (RCB) Score 2 bis 3]. Keine der Patientinnen hatte präoperativ Tamoxifen erhalten. Bei der grafischen Darstellung der TMEM-Scores für jeden einzelnen Patienten (Abb. 7A) wurden folgende Beobachtungen gemacht: (i) Bei den meisten Patienten stiegen die TMEM-Scores nach der NAK an, bei einigen sogar um mehr als das Fünffache (Patienten Nr. 3, Nr. 11, Nr. 15, Nr. 19 und Nr. 20); (ii) Die TMEM-Werte von 50 % der Patienten verschoben sich nach der NAK von der Gruppe mit niedrigem/mittlerem in die Gruppe mit hohem Risiko (Wert ≥ 23; rote Linie in der Grafik) [TMEM-Wert von 23 wurde als Grenzwert festgelegt, der die Patienten in Gruppen mit niedrigem/mittlerem und hohem Risiko für die Entwicklung von Fernmetastasen einteilt (5)]; (iii) bei 15 % der Patienten, die vor der NAK hohe TMEM-Werte aufwiesen (Patienten Nr. 4, Nr. 9 und Nr. 17), blieb der TMEM-Wert unverändert oder verschlechterte sich sogar bis zum Ende der Behandlung; und (iv) es gab keinen einzigen Patienten, bei dem sich der TMEM-Wert nach der NAK verringerte. Repräsentative Bilder der TMEM vor und nach der NAK sind für die Patienten Nr. 3 und Nr. 7 gezeigt (Abb. 7B). Bei der Analyse als Kohorte war der mittlere TMEM-Score bei den Proben nach NAK im Vergleich zu den Kernbiopsien vor NAK signifikant erhöht (Wilcoxon-Test; P < 0,0001) (Abb. 7C). Diese Daten legen nahe, dass NAC bei einigen Brustkrebspatientinnen unerwünschte Langzeitfolgen haben kann.
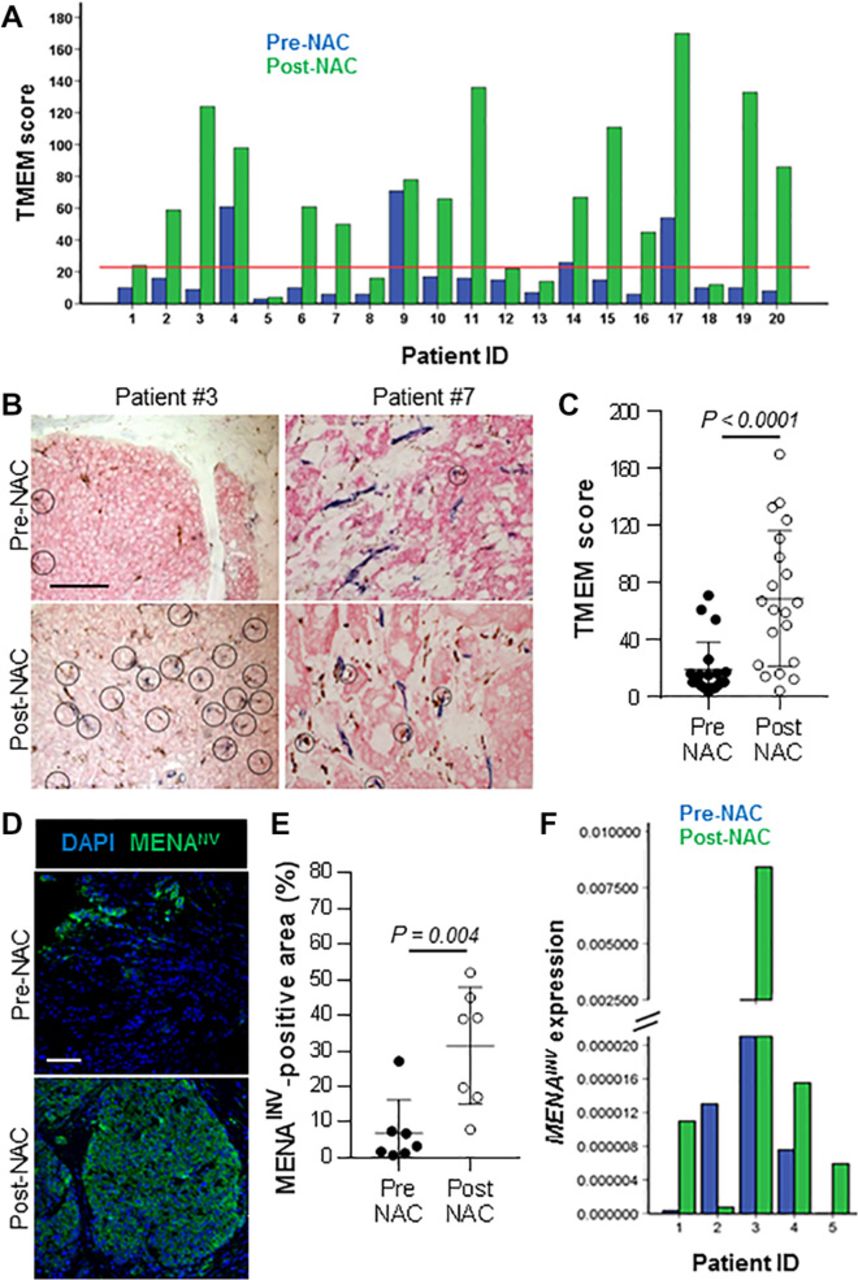
Abb. 7. NAC fördert bei Brustkrebspatientinnen den Aufbau von TMEM und eine erhöhte MENAINV-Expression.
(A) Individuelle TMEM-Scores von 20 Patientinnen vor und nach der Behandlung mit NAC, die wöchentliches Paclitaxel (80 mg/m2 × 12 aufeinanderfolgende Wochen) und anschließend eine dosisdichte AC-Chemotherapie [Doxorubicin (60 mg/m2) und Cyclophosphamid (600 mg/m2) alle 2 Wochen × vier Zyklen, plus Pegfilgrastim (6 mg, subkutan) an Tag 2 jedes Zyklus] umfasste. Die Patientinnen erhielten kein Tamoxifen. Rote Linie: TMEM-Hochrisiko-Cutoff-Punkt gemäß (5). (B) Repräsentative Bilder der TMEM-Dreifachfärbung IHC bei den Patienten Nr. 3 und Nr. 7 in den Kernbiopsien vor der NAK (obere Felder) und den resezierten Tumoren nach der NAK (untere Felder). Maßstabsbalken, 50 μm. (C) Mittlere TMEM-Werte in den 20 in (A) gezeigten menschlichen Brusttumoren vor und nach der Behandlung mit NAC, Wilcoxon-Test. (D) Repräsentative Bilder der MENAINV-Proteinexpression, visualisiert durch MENAINV IF und DAPI bei einer Patientin, die NAC erhielt. Maßstabsbalken, 100 μm. (E) Quantifizierung der MENAINV-positiven Fläche in Patientenproben vor und nach NAC. Der Test wurde nur bei sieben der in (A) gezeigten Patienten durchgeführt, da für die verbleibenden 13 Patienten nur begrenztes Biopsiematerial vor der NAK zur Verfügung stand. Mann-Whitney-U-Test. (F) MENAINV-Genexpression, bewertet durch Echtzeit-RT-PCR, in FNA-Biopsien von fünf Brustkrebspatientinnen vor und nach zweiwöchiger Behandlung mit NAC und Paclitaxel.
Um die translationale Bedeutung unserer präklinischen Daten von PyMT- und PDX-Mäusen, die neoadjuvantes Paclitaxel erhielten, weiter zu untermauern, verglichen wir die MENAINV-Expression in Proben vor und nach NAC. Wir beobachteten eine signifikante Zunahme (P < 0,01) der MENAINV-positiven Fläche zwischen den Biopsien vor und nach der NAK (Abb. 7, D und E). Darüber hinaus analysierten wir die MENAINV-Expression mittels qRT-PCR in Feinnadelaspirationsbiopsien (FNA), die vor und eine Woche nach der zweiten wöchentlichen Paclitaxel-Dosis in einer unabhängigen kleinen Patientenkohorte (n = 5) entnommen wurden. Selbst in einer so frühen Phase der Paclitaxel-Behandlung konnten wir bei vier von fünf Brustkrebspatientinnen (Patientinnen Nr. 1 und Nr. 3 bis 5) einen Anstieg der MENAINV-Genexpression beobachten (Abb. 7F), was darauf hindeutet, dass die TMEM- und MENA-abhängigen prometastatischen Veränderungen bei diesen Patientinnen bereits begonnen haben könnten.
Die Hemmung des TIE2-Rezeptors kehrt die Paclitaxel-vermittelten prometastatischen Veränderungen um
Wir postulierten, dass selektive TIE2-Inhibitoren nicht nur erfolgreich eingesetzt werden könnten, um dem angiogenen Potenzial der NAC-induzierten Infiltration endothelialer Vorläuferzellen (9, 12, 13, 35, 36) entgegenzuwirken, sondern auch TMEM- und MENA-abhängigen prometastatischen Veränderungen, da TIE2-Inhibitoren auf TMEM-assoziierte TIE2hi/VEGFhi-Makrophagen abzielen könnten.
Um diese Frage zu klären, untersuchten wir zunächst die Auswirkungen von Rebastinib, einem TIE2-Inhibitor, auf die TMEM-Zusammensetzung, die Gefäßpermeabilität und die CTCs in den PyMT-Transplantations- und HT17-PDX-Mammatumor-Modellen, die in unseren Studien verwendet wurden. Die Tiere erhielten NAC mit oder ohne Rebastinib (Abb. 8, A und B). Die Behandlung mit Rebastinib allein hatte keinen signifikanten Einfluss auf den TMEM-Gesamtscore (Abb. 8, C und D) oder die Dichte der perivaskulären TIE2hi/VEGFhi-Makrophagen (Abb. 8, E und F). Es reduzierte jedoch signifikant (P < 0,01) die Anzahl der CTCs in beiden Tiermodellen (Abb. 8, G und H) und beeinträchtigte damit die hämatogene Dissemination, ohne den Aufbau von TMEM-Intravasionsstellen zu beeinflussen, was auf eine Hemmung der TMEM-Aktivität hinweist.

Abb. 8. Der TIE2-Inhibitor Rebastinib eliminiert die prometastatischen Effekte von Paclitaxel.
(A) Versuchsaufbau und Chemotherapie-Schema. (B) Mausmodelle des Mammakarzinoms und Kohortengrößen. (C und D) TMEM-Scores im PyMT-Transplantationsmodell (C) und im HT17-Xenotransplantationsmodell (D), behandelt mit Vehikelkontrolle, Rebastinib, Paclitaxel oder einer Kombination aus Rebastinib und Paclitaxel. Mann-Whitney-U-Test. (E und F) Quantifizierung der perivaskulären TIE2hi/VEGFhi-Makrophagen in 10 HPFs im PyMT-Transplantationsmodell (E) oder im HT17-Xenotransplantationsmodell (F), behandelt mit der Vehikelkontrolle Rebastinib, Paclitaxel oder einer Kombination von Rebastinib mit Paclitaxel. Mann-Whitney-U-Test. (G und H) CTCs pro Milliliter Blut, die vor der Tötung (Tag 15) der Mäuse gesammelt wurden [PyMT-Transplantation (G); HT17 Xenotransplantation (H)]. Die Werte wurden jeweils auf die Kontrollgruppe normalisiert, um die Variabilität zwischen den Kohorten zu berücksichtigen. Mann-Whitney-U-Test. (I) Häufigkeit von Bursting (mindestens ein vollständiges Ereignis während der 4,5-stündigen Bildgebung pro Maus) bei mit Paclitaxel behandelten MMTV-PyMT/Dendra2 cfms-CFP-Mäusen, die Rebastinib erhielten oder nicht. (J) Häufigkeit von Bursting bei mit Paclitaxel behandelten MMTV-PyMT/Dendra2 cfms-CFP-Mäusen, die Rebastinib erhielten oder nicht. Mann-Whitney-U-Test. (K) Vorgeschlagenes Modell der Chemotherapie-induzierten prometastatischen Veränderungen und der Verbreitung von Krebszellen. Die Chemotherapiebehandlung erhöht die Dichte der TIE2hi/VEGFhi-Makrophagen im Primärtumor. Diese Makrophagen induzieren nicht nur die Angiogenese, sondern bauen auch aktive TMEM-Strukturen auf. Die Chemotherapie erhöht auch die Expression des Aktin-regulierenden Proteins MENAINV-Isoform in den Tumorzellen aufgrund ihres Kontakts mit den infiltrierenden Makrophagen, wodurch diese Krebszellen stark migratorisch und invasiv werden. Wenn sie die Blutgefäße erreichen, bilden einige der MENAINV-exprimierenden Krebszellen aktive TMEM-Stellen, die dann von anderen MENAINV-exprimierenden Zellen zur Invasion genutzt werden. Die durch die Chemotherapie vermittelte Überexpression von MENAINV und der Aufbau von TMEM bei Brustkrebs tragen gemeinsam zur TMEM-abhängigen Verbreitung von Krebszellen und zur Fernmetastasierung bei. Die gezielte Beeinflussung der Funktion der TMEM-assoziierten Makrophagen-Subpopulation durch einen TIE2-Inhibitor wirkt der durch die Chemotherapie induzierten TMEM-vermittelten Verbreitung von Krebszellen entgegen.
Die Behandlung mit Paclitaxel allein führte zu einem Anstieg der perivaskulären TIE2hi/VEGFhi-Makrophagen, des TMEM-Aufbaus und der Aktivität (Abb. 8, C bis H), was mit den Abbildungen 1 und 3 übereinstimmt. Die Verabreichung von Rebastinib bei mit Paclitaxel behandelten Tieren verringerte jedoch die Anzahl der perivaskulären TIE2hi/VEGFhi-Makrophagen (Abb. 8E) und reduzierte die CTCs auf das Niveau, das bei den Kontrolltieren beobachtet wurde (Abb. 8, G und H), ohne die TMEM-Zusammensetzung zu beeinflussen (Abb. 8, C und D). Diese Daten deuten darauf hin, dass die Hemmung von TIE2 erfolgreich die Funktion, aber nicht den Zusammenbau von TMEM-Stellen blockiert, was ausreicht, um die Verbreitung von Krebszellen zu unterdrücken.
Als Nächstes untersuchten wir, ob die durch Rebastinib vermittelte Unterdrückung der Tumorzellverbreitung, die bei den mit Paclitaxel behandelten Mäusen beobachtet wurde, auf die Hemmung der TMEM-assoziierten Makrophagenfunktion zurückzuführen ist. Um diese Frage zu klären, verwendeten wir IVI (Abb. 8, A und B) und stellten erneut fest, dass das Auftreten und die Häufigkeit von Bursting, einer TMEM-assoziierten Aktivität, mit den zuvor gewonnenen Daten in der „Paclitaxel-only“-Gruppe übereinstimmten (vgl. Abb. 8, I und J, mit Abb. 3, B und C). Die gleichzeitige Verabreichung von Rebastinib bei Paclitaxel-behandelten Mäusen führte jedoch zu einer vollständigen Aufhebung der Häufigkeit und des Auftretens von Bursting (Abb. 8, I und J), was darauf hindeutet, dass die Hemmung von TIE2 die durch die Chemotherapie ausgelöste TMEM-vermittelte vaskuläre Permeabilität und die Ausbreitung von Krebszellen blockiert.
DISKUSSION
Immer mehr Hinweise deuten darauf hin, dass die Chemotherapie eine Reparaturreaktion des Wirts hervorruft, bei der Zellen aus dem Knochenmark (BMDCs) in die Mikroumgebung des Primärtumors eindringen und die Neoangiogenese und das erneute Wachstum des Tumors erleichtern (10, 11). Hier haben wir gezeigt, dass NAC durch eine solche BMDC-Rekrutierung die Verbreitung von Krebszellen fördern und einen aggressiveren Tumorphänotyp mit verstärkter Metastasierung hervorrufen kann. Der Mechanismus beinhaltet sowohl die Bildung von TMEM-Stellen als auch die erhöhte MENAINV-Expression im Restkrebs nach NAC. Diese Ergebnisse stehen im Einklang mit unseren früheren Erkenntnissen, dass die MENA-Expression für die TMEM-Zusammensetzung und die Verbreitung von Krebszellen durch einen TMEM-MENAINV– und TIE2hi/VEGFhi-Makrophagen-abhängigen Mechanismus erforderlich ist (1, 20, 21, 29). Obwohl die Auswirkungen von Taxanen und anderen Chemotherapeutika auf die Neovaskularisation hinreichend beschrieben wurden (8, 10, 12, 13, 35, 43), bietet unsere Studie einen Einblick in die Mechanismen, durch die Paclitaxel und andere Chemotherapeutika die Krebsmikroumgebung modulieren, um die Intravasation von Brustkrebszellen und die Verbreitung an entfernte Orte zu fördern, sowie einen TIE2-gesteuerten therapeutischen Ansatz, um der Paclitaxel-vermittelten Induktion der Krebszellverbreitung entgegenzuwirken (Abb. 8K). Daher konzentriert sich diese Arbeit in erster Linie auf die Wirkung der Chemotherapie auf die Verbreitung von Krebszellen über TMEM/MENA-vermittelte Mechanismen.
Wir haben gezeigt, dass die Chemotherapie die Makrophagendichte in einem PDX-Modell erhöht, nicht aber bei spontaner PyMT. Unsere Ergebnisse im PyMT-Modell stehen im Widerspruch zu denen der Coussens-Gruppe (44). Dies mag daran liegen, dass wir mit 8 bis 9 Wochen alten Mäusen mit Spontankarzinomen im Frühstadium arbeiteten, während die Coussens-Gruppe mit 12 Wochen alten Mäusen arbeitete, die in der Regel Tumore im fortgeschrittenen Stadium haben. Unsere Ergebnisse zeigen jedoch, dass die Chemotherapie eine Zunahme der perivaskulären TIE2hi/VEGFhi-Makrophagen fördert (Abb. 8K), was mit Studien übereinstimmt, die zeigen, dass diese Population mit Stellen der (patho)physiologischen Angiogenese assoziiert ist, insbesondere als Reparaturmechanismus des Wirts nach zytotoxischen Schäden durch Chemotherapie (14, 15, 45-47). Obwohl nicht klar ist, ob TIE2hi/VEGFhi-Makrophagen zur „klassisch aktivierten“ (M1) oder zur „alternativ aktivierten“ (M2) Gruppe gehören, sind sie entscheidend für die Modulation der Tumormikroumgebung als Reaktion auf zytotoxische Therapien (10, 48). Unsere Beobachtung, dass andere Chemotherapeutika wie Doxorubicin/Cyclophosphamid in der Lage sind, perivaskuläre TIE2hi/VEGFhi-Makrophagen zu rekrutieren, TMEM zu bilden und eine TMEM-abhängige Intravasation von Tumorzellen zu bewirken, unterstützt die Idee, dass der Mechanismus, durch den die Chemotherapie diese prometastatischen Wirkungen hervorruft, ein allgemeiner Wirtsreparaturmechanismus als Reaktion auf umfangreiche Gewebeschäden ist und kein Paclitaxel-spezifisches Phänomen. Zum Beispiel exprimieren TIE2+-Makrophagen auch den Chemokinrezeptor CXCR4, und die Chemotherapie kann die Expression des CXCR4-Liganden CXCL12 in der Mikroumgebung des Primärtumors erhöhen (10). Daher ist es sehr wahrscheinlich, dass die prometastatischen TIE2hi/VEGFhi-Makrophagen bei chemotherapeutisch behandelten Personen über eine andere chemotaktische Achse rekrutiert werden.
Darüber hinaus erhöht die verstärkte Makrophageninfiltration in den Tumor nach einer Paclitaxel-Behandlung den Kontakt zwischen Tumorzellen und Makrophagen, was bekanntermaßen die Expression von MENAINV über die Aktivierung des NOTCH-Signalwegs stimuliert, was zu einer erhöhten MENAINV– und TMEM-abhängigen Intravasation führt (27). Diese Beobachtungen deuten darauf hin, dass die Paclitaxel-Behandlung die Expression von MENAINV und MENACalc durch die chemotherapiebedingte Makrophageninfiltration induziert haben könnte, was zu einer erhöhten TMEM-Assemblierung und -Funktion führt, wie hier beschrieben (Abb. 8K). Dabei könnte es sich um einen aktiven Prozess handeln und nicht einfach um das Ergebnis eines selektiven Überlebens von MENA-exprimierenden Tumorzellen während der Paclitaxel-Behandlung (49). Ansonsten stimmen unsere Daten mit den Ergebnissen von Oudin et al. (49) überein, die eine erhöhte MENA- und MENAINV-Expression in mit Paclitaxel behandelten Xenotransplantaten im Vergleich zu MDA-MB-231-Kontrolltumoren zeigten.
Die beobachtete Zunahme der sich ausbreitenden Tumorzellen nach einer Chemotherapie als direkte Folge der durch den Makrophagenkontakt induzierten MENAINV-Überexpression wird durch zwei wichtige Erkenntnisse gestützt, über die hier berichtet wird. Erstens korrelierte die Expression von MENAINV und MENACalc besonders gut mit TIE2hi-Makrophagen, was mit früheren Studien am Menschen und an Mäusen (18, 20, 29) übereinstimmt. Zweitens wurde durch das Fehlen aller MENA-Isoformen die Verbreitung von Krebszellen und die Fernmetastasierung in vivo vollständig unterbunden, und zwar unabhängig davon, ob die Mäuse Paclitaxel erhielten oder nicht, und ohne Beeinträchtigung der Rekrutierung von TIE2hi/VEGFhi-Makrophagen, was darauf hindeutet, dass die MENA-Expression eine wesentliche Voraussetzung für die Paclitaxel-induzierte transendotheliale Migration von Brustkrebszellen in vivo ist.
Unsere Studie zeigt, dass der TMEM-Score und MENAINV in Brustkrebsproben von Patientinnen, die mit NAC einschließlich Doxorubicin, Cyclophosphamid und Paclitaxel behandelt wurden, ansteigen, was darauf hindeutet, dass der TMEM-Score und MENAINV zur Vorhersage der Entwicklung von prometastatischen Veränderungen in der Mikroumgebung des Primärtumors als Reaktion auf NAC verwendet werden könnten. Dies ist wichtig, da viele Brustkrebspatientinnen mit NAK behandelt werden, die in der Regel etwa 6 Monate dauert, und es derzeit keine Marker gibt, die das Ansprechen auf NAK vorhersagen (43). Unsere Daten deuten darauf hin, dass NAC bei Patientinnen, die nach der NAC eine RCB haben, z. B. bei ER+, trotz teilweiser Tumorregression über TMEM Metastasen auslösen kann. Insbesondere erreichen nur 16,5 % der Patientinnen mit ER+/HER2- Erkrankung ein pathologisches vollständiges Ansprechen (pCR) mit NAC, was darauf hindeutet, dass unsere Ergebnisse auf die Mehrheit der Patientinnen zutreffen könnten, d. h. auf diejenigen, die keine pCR erreichen (50). Obwohl die Zugabe von Paclitaxel zur NAK den Prozentsatz der Patienten mit pCR erhöht, verbessert sie nicht das Gesamtüberleben (6, 7), was darauf hindeutet, dass einige Patienten keinen langfristigen Nutzen aus der NAK ziehen. Da wir gezeigt haben, dass MENAINV nach nur zwei Chemotherapiedosen bei einigen Patienten ansteigt, spekulieren wir, dass der Expressionsstatus der MENA-Isoform in der FNA-Biopsie nach den ersten zwei Wochen der Chemotherapie vorhersagen könnte, welche Patienten den vollen Nutzen aus der NAK ziehen würden und bei welchen die Fortsetzung der NAK schädlich wäre. So könnte beispielsweise ein Ansatz entwickelt werden, um die Expression von MENAINV in FNA-Proben nach der zweiten Chemotherapie-Dosis routinemäßig zu bewerten. Wenn die invasiven Isoformen von MENA nicht ansteigen, könnte die Chemotherapie bis zu ihrem Ende fortgesetzt werden. Kommt es hingegen zu einem Anstieg der invasiven MENA-Isoform, könnte die Chemotherapie abgebrochen werden, und die Patienten könnten zunächst operiert und anschließend mit einer Chemotherapie behandelt werden. Die Wirksamkeit eines solchen Ansatzes müsste jedoch in künftigen Studien untersucht werden.
Unsere Kohorte von 20 Patientinnen mit ER+-Krankheit hatte nur eine Nachbeobachtungszeit von 5 Jahren, was nicht ausreicht, um Fernrezidive bei diesem Brustkrebs-Subtyp zuverlässig zu analysieren, da ER+-Krankheiten häufig 10 oder mehr Jahre nach der Erstdiagnose wieder auftreten (51). Zwei retrospektiv-prospektive Analysen menschlicher Brustkrebsproben deuten jedoch darauf hin, dass ein erhöhter TMEM-Score mit dem Metastasierungserfolg der Patientinnen in Verbindung steht (3, 5). Diese Studien deuten darauf hin, dass bei einer angemessenen Nachbeobachtungszeit der Anstieg des TMEM-Scores nach einer Chemotherapie bei einem Teil der Patientinnen zu einem Fernrezidiv führen sollte. Eine Folgestudie ist erforderlich, um festzustellen, ob Patienten mit einem Anstieg des TMEM-Scores nach einer NAK häufiger ein Fernrezidiv entwickeln als Patienten ohne einen Anstieg des TMEM-Scores. Darüber hinaus muss, wie bereits erwähnt, festgestellt werden, ob wir durch die Bewertung von MENAINV vorhersagen können, welche Patienten wahrscheinlich auf NAC ansprechen werden, so dass die Behandlung entsprechend angepasst werden kann.
Um klinisch relevante Szenarien genau widerzuspiegeln, haben wir in unserer Studie hauptsächlich PyMT-Tumore im Frühstadium verwendet. Wie die American Cancer Society in Breast Cancer Facts & Figures 2015-2016 berichtet, ist die Inzidenzrate bei Tumoren <2 cm am höchsten (70 pro 100.000), gefolgt von Tumoren zwischen 2 und 4,9 cm (35 pro 100.000) (32). Tumore >5 cm hatten eine Inzidenzrate von nur 10 pro 100.000. Ebenso übersteigt die Inzidenzrate für lokalisierte (40 bis 90 pro 100.000) und regionale (25 bis 40 pro 100.000) Erkrankungen bei weitem die Inzidenzrate für entfernte (5 bis 11 pro 100.000) Erkrankungen (32). Darüber hinaus haben wir durch die Auswahl von PyMT-Tumoren im Frühstadium vermieden, potenziell TMEM-unabhängige Mechanismen der Krebszellverbreitung zu messen, die sich aus einem offenen Kreislaufeffekt ergeben könnten, wie z. B. bei der Zerstörung des Gefäßsystems in nekrotischen Läsionen im fortgeschrittenen Stadium.
Unsere Feststellung, dass Paclitaxel einen Anstieg der CTCs bewirkt, deckt sich mit kürzlich berichteten Daten aus Patientenstudien, die sich auf die Wirkung der Chemotherapie auf CTCs konzentrieren. Obwohl die mit dem von der US Food and Drug Administration zugelassenen CellSearch System gemessene CTC-Zahl sowohl bei primärem als auch bei metastasiertem Brustkrebs ein wichtiger Prognosefaktor ist, gibt es in der Literatur keine schlüssigen Beweise dafür, dass eine Chemotherapie die CTCs signifikant reduziert (52). Im Gegenteil, mehrere Berichte deuten darauf hin, dass die CTC-Zahlen in Blutproben nach der Chemotherapie bei einigen Patienten zunehmen und bei anderen abnehmen, nicht mit der pCR korrelieren und mit dem fernmetastasenfreien Überleben korrelieren (53, 54). Wenn bei der CTC-Suche auch Zellen mit Expression von Markern für den epithelial-mesenchymalen Übergang berücksichtigt wurden, wiesen 21 % der Patienten nach NAC eine erhöhte CTC-Zahl auf, während bei 15 % die CTC-Zahl nach NAC abnahm (54). Unsere Daten, die darauf hindeuten, dass NAC bei einigen Patienten zu einem Anstieg der CTCs führen könnte, stimmen also mit der aktuellen Literatur überein.
Eine Einschränkung dieser Studie besteht darin, dass sie sich nicht vollständig mit der Entwicklung klinisch nachweisbarer Metastasen befasst, die neben der Ausbreitung der Krebszellen auch andere Prozesse wie die Befreiung aus dem Ruhezustand und das Tumorwachstum umfasst. Eine weitere Einschränkung besteht darin, dass diese Studie aufgrund des langen Zeitraums zwischen der Diagnose und dem Rückfall bei ER+-Krankheit keine Beweise dafür liefern konnte, dass erhöhte TMEM- und MENAINV-Werte in Proben von Patientinnen nach NAK mit dem Metastasierungsergebnis korrelieren.
Da metastasierende Erkrankungen die Hauptursache für die krebsbedingte Sterblichkeit sind und derzeit nicht geheilt werden können, ist es von entscheidender Bedeutung, dass wir Strategien entwickeln, um das Fortschreiten des Krebses bis zum metastasierenden Stadium und die weitere Ausbreitung von bereits bestehenden metastasierenden Herden zu verhindern. Daher ist unsere Erkenntnis, dass eine Chemotherapie bei klinisch aktiver Erkrankung die Ausbreitung von Krebszellen fördern kann, sehr besorgniserregend. Unsere Daten deuten jedoch darauf hin, dass Strategien entwickelt werden können, um die durch die Chemotherapie induzierte TMEM/MENA-vermittelte Ausbreitung von Krebszellen und die anschließende Metastasierung zu verhindern. Dies kann entweder durch das Absetzen von NAC bei Patientinnen geschehen, deren Tumoren NAC-induzierte prometastatische Veränderungen aufweisen, oder durch die Kombination von NAC mit Wirkstoffen, die die TMEM/MENA-vermittelte Krebszelldissemination blockieren, wie z. B. selektive TIE2-Inhibitoren, was nicht nur bei der NAC-Behandlung von lokalem Brustkrebs, sondern auch bei der Behandlung von metastasiertem Brustkrebs nützlich wäre.
MATERIALIEN UND METHODEN
Studienaufbau
Das Hauptziel dieser Studie war die Untersuchung der prometastatischen Wirkung von NAC in Mausmodellen von Brustkrebs, Brustkrebs-PDXs und menschlichen Patienten. Die Mäuse wurden nach dem Zufallsprinzip zwei Behandlungsgruppen zugeteilt: einer Gruppe, die mit dem Vehikel behandelt wurde, und einer Gruppe, die mit einer Chemotherapie behandelt wurde. Es wurden zwei Chemotherapieschemata durchgeführt: Paclitaxel oder Doxorubicin/Cyclophosphamid. Nach Beendigung der Behandlung wurden die Mäuse entweder einer IVI unterzogen, um die Wirkung der Chemotherapie auf die Gefäßpermeabilität (Bursting) zu beurteilen, oder sie wurden getötet und auf TIE2hi/VEGFhi-Makrophagen, TMEM-Assemblierung, TMEM-abhängige Gefäßpermeabilität, CTCs, Metastasenausbreitung in der Lunge sowie Gen- und Proteinexpression der invasiven MENA-Isoform MENAINV untersucht. Das sekundäre Ziel bestand darin, zu untersuchen, ob der TIE2-Inhibitor Rebastinib in der Lage ist, die im ersten Teil der Studie beschriebenen Chemotherapie-vermittelten prometastatischen Effekte in denselben Mausmodellen für Brustkrebs zu unterdrücken. Alle Mäuse erhielten NAC mit Paclitaxel und wurden nach dem Zufallsprinzip in zwei Gruppen eingeteilt: Vehikel- oder Rebastinib-Behandlung. Nach Beendigung der Behandlung wurden die Mäuse entweder einer IVI unterzogen oder geopfert, um die TIE2hi/VEGFhi-Makrophagen, den TMEM-Aufbau und die CTCs zu untersuchen.
Statistische Analyse
Die GraphPad Prism 6 Software wurde für die Erstellung von Grafiken und Plots sowie für statistische Hypothesentests verwendet. Kontinuierliche Variablen (Tumorvolumen, TMEM-Score, CTCs pro Milliliter Blut, Makrophagenzahl sowie Gen- und Proteinexpressionswerte) werden als Punktdiagramme mit Mittelwert und SD dargestellt. Vergleiche zwischen zwei unabhängigen Stichproben wurden mit dem zweiseitigen Mann-Whitney-U-Test durchgeführt, und Vergleiche mit übereinstimmenden Stichproben wurden mit dem Wilcoxon-Test durchgeführt. Korrelationen wurden anhand der Pearson-Korrelation und des Bestimmtheitsmaßes (R2) analysiert, und die Daten wurden als Streudiagramme mit Anpassungslinien und entsprechenden P-Werten dargestellt. Zur Untersuchung von Unterschieden bei binären Ergebnissen (Auftreten von Metastasen) zwischen zwei Gruppen wurden Kreuztabellen und χ2-Tests durchgeführt. In allen Diagrammen werden P-Werte von <0,1 angegeben; allerdings werden nur P-Werte von <0,05 als statistisch signifikant bezeichnet.
Bei der Berechnung des Stichprobenumfangs wurden folgende Parameter zugrunde gelegt: Signifikanzniveau (bereinigt um die Einseitigkeit) von 0,025, Wahrscheinlichkeit eines Fehlers vom Typ II von 0,2 (statistische Aussagekraft von 0,8) und erwartete Differenz der Mittelwerte von 1,2 SD-Einheiten, basierend auf der Annahme, dass die SD der Antwortvariablen 1 Einheit beträgt. Für die Teilnahme an allen parallelen Studien mit zwei Behandlungen wurde eine Gesamtzahl von 22 Tieren (11 Tiere pro Gruppe) berechnet.
Die folgenden Tiere wurden aus der Studie entfernt: Mäuse, deren Tumore nekrotisch oder zystisch waren; Mäuse mit unzureichendem Tumorgewebe für die Durchführung von TMEM-Zählungen, IHC/IF oder RNA-Extraktion; Mäuse mit weniger als 0,5 ml Blut, das durch Herzpunktion für den CTC-Test entnommen wurde; und Mäuse, die entweder fettleibig (>33 g) oder abgemagert (<17 g) waren. Dementsprechend kann die Anzahl der Mäuse in den einzelnen Abbildungen um bis zu 25 % gegenüber der ursprünglichen Kohortengröße in den entsprechenden Abbildungen (Abb. 1B, 2B, 5B, 6B und 8B) reduziert worden sein.
Transgene MMTV-PyMT-Tiere sowie Tiere, die mit syngenen oder von Patienten stammenden Tumoren transplantiert wurden, wurden gemäß den Vorschriften des Albert Einstein College of Medicine Animal Care and Use Committee in Käfigen mit fünf Tieren untergebracht. Sobald sie die Kriterien für die Aufnahme in die Versuchsreihe erfüllten (Tumordurchmesser von ~2 bis 3 mm), wurden die Tiere nach dem Zufallsprinzip den mit Chemotherapie, Rebastinib oder Vehikel behandelten Gruppen zugewiesen.
Alle Pathologen, die an der TMEM-Auswertung beteiligt waren, waren gegenüber der Gruppenzuordnung verblindet (Abb. S10), ebenso wie die Wissenschaftler, die die IVI-, CTC-Auswertung, IF/IHC- und qRT-PCR-Analysen in Maus- und Humanproben durchführten. Allerdings sind Biopsien vor der NAK bei menschlichen Patienten mikroskopisch leicht von reseziertem Tumorgewebe zu unterscheiden, so dass eine Verblindung für die TMEM-Bewertung bei menschlichen Brustkrebspatientinnen, die NAK erhalten, nicht möglich war.
Danksagung
Wir danken der Histopathology Core Facility am Albert Einstein College of Medicine für die Unterstützung bei der IHC und der Analytical Imaging Facility für die Unterstützung bei der Bildgebung und Mikroskopie. Wir danken auch R. Eddy und M. Chen für die Entwicklung und Validierung des MENAINV-Antikörpers, J. Lin für die Hilfe bei ausgewählten Datenanalysen und Y. Lin für die technische Unterstützung. Schließlich danken wir Deciphera Pharmaceuticals für die Bereitstellung von Rebastinib für die in Abb. 8 beschriebenen Experimente. Finanzierung: Unsere Arbeit wurde durch Zuschüsse des NIH (CA100324, CA150344 und 1T32CA200561-01), des T32 Research Training Grant of Surgeons, der SIG 1S10OD019961-01, des Gruss Lipper Biophotonics Center und des Integrated Imaging Program am Albert Einstein College of Medicine unterstützt. Beiträge der Autoren: G.S.K. plante und führte die Experimente durch, analysierte und interpretierte die Daten, koordinierte das Projekt und schrieb das Manuskript mit. J.M.P. führte die IVI-Experimente durch. Y.W. führte die Tierbehandlung durch. A.S.H. und E.A.X. führten die IF-Bildgebung durch. D.E. entwickelte die Bildanalyse-Software und führte die IVI durch. V.P.S. steuerte das HyperStackReg-Plug-in für die Bildausrichtung in intravitalen Filmen bei und half bei der Definition der Methodik für die Erstellung von Ausschlussmasken für die Gefäßpermeabilität in ImageJ. J.P. führte qRT-PCR für MENAINV in FNA-Biopsien von Patienten durch. J.G.J. analysierte die TMEM-Dreifachfärbung. J.A., E.C., T.M.D. und J.A.S. stellten menschliche Proben für die Histopathologie zur Verfügung. T.E.R. trug zur Datenauswertung bei. J.S.C. leitete die Multiphotonen-Bildgebung und die Interpretation der IF-Daten. M.H.O. leitete die histologischen und IHC-Experimente (TMEM-Dreifachfärbung). J.S.C. und M.H.O. konzipierten die Hypothese, leiteten das Projekt, interpretierten die Daten und schrieben das Manuskript. Konkurrierende Interessen: J.S.C. und M.H.O. sind Erfinder eines vom Albert Einstein College of Medicine eingereichten Patentantrags (#96700/2505), der Methoden zum Nachweis und zur Verringerung von Chemotherapie-induzierten prometastatischen Veränderungen in Brusttumoren umfasst. Alle anderen Autoren erklären, dass sie keine konkurrierenden Interessen haben.
REFERENZEN UND HINWEISE
REFERENZEN UND HINWEISE
- A. S. Harney, E. N. Arwert, D. Entenberg, Y. Wang, P. Guo, B.-Z. Qian, M. H. Oktay, J. W. Pollard, J. G. Jones, J. S. Condeelis, Real-time imaging reveals local, transient vascular permeability, and tumor cell intravasation stimulated by TIE2hi macrophage–derived VEGFA. Cancer Discov. 5, 932–943 (2015).
- G. S. Karagiannis, S. Goswami, J. G. Jones, M. H. Oktay, J. S. Condeelis, Signatures of breast cancer metastasis at a glance. J. Cell Sci. 129, 1751–1758 (2016).
- B. D. Robinson, G. L. Sica, Y.-F. Liu, T. E. Rohan, F. B. Gertler, J. S. Condeelis, J. G. Jones, Tumor microenvironment of metastasis in human breast carcinoma: A potential prognostic marker linked to hematogenous dissemination. Clin. Cancer Res. 15, 2433–2441 (2009).
- M. H. Oktay, F. B. Gertler, Y.-F. Liu, T. E. Rohan, J. S. Condeelis, J. G. Jones, Correlated immunohistochemical and cytological assays for the prediction of hematogenous dissemination of breast cancer. J. Histochem. Cytochem. 60, 168–173 (2012).
- T. E. Rohan, X. Xue, H.-M. Lin, T. M. D’Alfonso, P. S. Ginter, M. H. Oktay, B. D. Robinson, M. Ginsberg, F. B. Gertler, A. G. Glass, J. A. Sparano, J. S. Condeelis, J. G. Jones, Tumor microenvironment of metastasis and risk of distant metastasis of breast cancer. J. Natl. Cancer Inst. 106, dju136 (2014).
- P. Rastogi, S. J. Anderson, H. D. Bear, C. E. Geyer, M. S. Kahlenberg, A. Robidoux, R. G. Margolese, J. L. Hoehn, V. G. Vogel, S. R. Dakhil, D. Tamkus, K. M. King, E. R. Pajon, M. J. Wright, J. Robert, S. Paik, E. P. Mamounas, N. Wolmark, Preoperative chemotherapy: Updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27. J. Clin. Oncol. 26, 778–785 (2008).
- L. Gianni, J. Baselga, W. Eiermann, V. G. Porta, V. Semiglazov, A. Lluch, M. Zambetti, D. Sabadell, G. Raab, A. L. Cussac, A. Bozhok, A. Martinez-Agulló, M. Greco, M. Byakhov, J. J. L. Lopez, M. Mansutti, P. Valagussa, G. Bonadonna, Phase III trial evaluating the addition of paclitaxel to doxorubicin followed by cyclophosphamide, methotrexate, and fluorouracil, as adjuvant or primary systemic therapy: European Cooperative Trial in Operable Breast Cancer. J. Clin. Oncol. 27, 2474–2481 (2009).
- L. G. M. Daenen, J. M. Houthuijzen, G. A. Cirkel, J. M. L. Roodhart, Y. Shaked, E. E. Voest, Treatment-induced host-mediated mechanisms reducing the efficacy of antitumor therapies. Oncogene 33, 1341–1347 (2014).
- M. De Palma, C. E. Lewis, Macrophage regulation of tumor responses to anticancer therapies. Cancer Cell 23, 277–286 (2013).
- R. Hughes, B.-Z. Qian, C. Rowan, M. Muthana, I. Keklikoglou, O. C. Olson, S. Tazzyman, S. Danson, C. Addison, M. Clemons, A. M. Gonzalez-Angulo, J. A. Joyce, M. De Palma, J. W. Pollard, C. E. Lewis, Perivascular M2 macrophages stimulate tumor relapse after chemotherapy. Cancer Res. 75, 3479–3491 (2015).
- J. M. L. Roodhart, H. He, L. G. M. Daenen, A. Monvoisin, C. L. Barber, M. van Amersfoort, J. J. Hofmann, F. Radtke, T. F. Lane, E. E. Voest, M. L. Iruela-Arispe, Notch1 regulates angio-supportive bone marrow–derived cells in mice: Relevance to chemoresistance. Blood 122, 143–153 (2013).
- Y. Shaked, A. Ciarrocchi, M. Franco, C. R. Lee, S. Man, A. M. Cheung, D. J. Hicklin, D. Chaplin, F. S. Foster, R. Benezra, R. S. Kerbel, Therapy-induced acute recruitment of circulating endothelial progenitor cells to tumors. Science 313, 1785–1787 (2006).
- Y. Shaked, E. Henke, J. M. L. Roodhart, P. Mancuso, M. H. G. Langenberg, M. Colleoni, L. G. Daenen, S. Man, P. Xu, U. Emmenegger, T. Tang, Z. Zhu, L. Witte, R. M. Strieter, F. Bertolini, E. E. Voest, R. Benezra, R. S. Kerbel, Rapid chemotherapy-induced acute endothelial progenitor cell mobilization: Implications for antiangiogenic drugs as chemosensitizing agents. Cancer Cell 14, 263–273 (2008).
- M. De Palma, M. A. Venneri, R. Galli, L. Sergi Sergi, L. S. Politi, M. Sampaolesi, L. Naldini, Tie2 identifies a hematopoietic lineage of proangiogenic monocytes required for tumor vessel formation and a mesenchymal population of pericyte progenitors. Cancer Cell 8, 211–226 (2005).
- M. De Palma, M. A. Venneri, C. Roca, L. Naldini, Targeting exogenous genes to tumor angiogenesis by transplantation of genetically modified hematopoietic stem cells. Nat. Med. 9, 789–795 (2003).
- A. Dovas, A. Patsialou, A. S. Harney, J. Condeelis, D. Cox, Imaging interactions between macrophages and tumour cells that are involved in metastasis in vivo and in vitro. J. Microsc. 251, 261–269 (2013).
- A. Patsialou, J. J. Bravo-Cordero, Y. Wang, D. Entenberg, H. Liu, M. Clarke, J. S. Condeelis, Intravital multiphoton imaging reveals multicellular streaming as a crucial component of in vivo cell migration in human breast tumors. Intravital 2, e25294 (2013).
- E. T. Roussos, J. S. Condeelis, A. Patsialou, Chemotaxis in cancer. Nat. Rev. Cancer 11, 573–587 (2011).
- S. Goswami, U. Philippar, D. Sun, A. Patsialou, J. Avraham, W. Wang, F. Di Modugno, P. Nistico, F. B. Gertler, J. S. Condeelis, Identification of invasion specific splice variants of the cytoskeletal protein Mena present in mammary tumor cells during invasion in vivo. Clin. Exp. Metastasis 26, 153–159 (2009).
- E. T. Roussos, S. Goswami, M. Balsamo, Y. Wang, R. Stobezki, E. Adler, B. D. Robinson, J. G. Jones, F. B. Gertler, J. S. Condeelis, M. H. Oktay, Mena invasive (MenaINV) and Mena11a isoforms play distinct roles in breast cancer cell cohesion and association with TMEM. Clin. Exp. Metastasis 28, 515–527 (2011).
- E. T. Roussos, M. Balsamo, S. K. Alford, J. B. Wyckoff, B. Gligorijevic, Y. Wang, M. Pozzuto, R. Stobezki, S. Goswami, J. E. Segall, D. A. Lauffenburger, A. R. Bresnick, F. B. Gertler, J. S. Condeelis, Mena invasive (MenaINV) promotes multicellular streaming motility and transendothelial migration in a mouse model of breast cancer. J. Cell Sci. 124, 2120–2131 (2011).
- J. Wyckoff, W. Wang, E. Y. Lin, Y. Wang, F. Pixley, E. R. Stanley, T. Graf, J. W. Pollard, J. Segall, J. Condeelis, A paracrine loop between tumor cells and macrophages is required for tumor cell migration in mammary tumors. Cancer Res. 64, 7022–7029 (2004).
- U. Philippar, E. T. Roussos, M. Oser, H. Yamaguchi, H.-D. Kim, S. Giampieri, Y. Wang, S. Goswami, J. B. Wyckoff, D. A. Lauffenburger, E. Sahai, J. S. Condeelis, F. B. Gertler, A Mena invasion isoform potentiates EGF-induced carcinoma cell invasion and metastasis. Dev. Cell 15, 813–828 (2008).
- A. Patsialou, J. Wyckoff, Y. Wang, S. Goswami, E. R. Stanley, J. S. Condeelis, Invasion of human breast cancer cells in vivo requires both paracrine and autocrine loops involving the colony-stimulating factor-1 receptor. Cancer Res. 69, 9498–9506 (2009).
- S. Goswami, E. Sahai, J. B. Wyckoff, M. Cammer, D. Cox, F. J. Pixley, E. R. Stanley, J. E. Segall, J. S. Condeelis, Macrophages promote the invasion of breast carcinoma cells via a colony-stimulating factor-1/epidermal growth factor paracrine loop. Cancer Res. 65, 5278–5283 (2005).
- E. Leung, A. Xue, Y. Wang, P. Rougerie, V. P. Sharma, R. Eddy, D. Cox, J. Condeelis, Blood vessel endothelium-directed tumor cell streaming in breast tumors requires the HGF/C-Met signaling pathway. Oncogene 36, 2680–2692 (2017).
- J. Pignatelli, J. J. Bravo-Cordero, M. Roh-Johnson, S. J. Gandhi, Y. Wang, X. Chen, R. J. Eddy, A. Xue, R. H. Singer, L. Hodgson, M. H. Oktay, J. S. Condeelis, Macrophage-dependent tumor cell transendothelial migration is mediated by Notch1/MenaINV-initiated invadopodium formation. Sci. Rep. 6, 37874 (2016).
- E. T. Roussos, Y. Wang, J. B. Wyckoff, R. S. Sellers, W. Wang, J. Li, J. W. Pollard, F. B. Gertler, J. S. Condeelis, Mena deficiency delays tumor progression and decreases metastasis in polyoma middle-T transgenic mouse mammary tumors. Breast Cancer Res. 12, R101 (2010).
- J. Pignatelli, S. Goswami, J. G. Jones, T. E. Rohan, E. Pieri, X. Chen, E. Adler, D. Cox, S. Maleki, A. Bresnick, F. B. Gertler, J. S. Condeelis, M. H. Oktay, Invasive breast carcinoma cells from patients exhibit MenaINV- and macrophage-dependent transendothelial migration. Sci. Signal. 7, ra112 (2014).
- L. Chen, J. Li, F. Wang, C. Dai, F. Wu, X. Liu, T. Li, R. Glauben, Y. Zhang, G. Nie, Y. He, Z. Qin, Tie2 expression on macrophages is required for blood vessel reconstruction and tumor relapse after chemotherapy. Cancer Res. 76, 6828–6838 (2016).
- A. Patsialou, Y. Wang, J. Lin, K. Whitney, S. Goswami, P. A. Kenny, J. S. Condeelis, Selective gene-expression profiling of migratory tumor cells in vivo predicts clinical outcome in breast cancer patients. Breast Cancer Res. 14, R139 (2012).
- A. C. Society, Breast Cancer Facts & Figures 2015-2016 (American Cancer Society Inc., 2015).
- T. Shree, O. C. Olson, B. T. Elie, J. C. Kester, A. L. Garfall, K. Simpson, K. M. Bell-McGuinn, E. C. Zabor, E. Brogi, J. A. Joyce, Macrophages and cathepsin proteases blunt chemotherapeutic response in breast cancer. Genes Dev. 25, 2465–2479 (2011).
- F. Pucci, M. A. Venneri, D. Biziato, A. Nonis, D. Moi, A. Sica, C. Di Serio, L. Naldini, M. De Palmax, A distinguishing gene signature shared by tumor-infiltrating Tie2-expressing monocytes, blood “resident” monocytes, and embryonic macrophages suggests common functions and developmental relationships. Blood 114, 901–914 (2009).
- C. Murdoch, M. Muthana, S. B. Coffelt, C. E. Lewis, The role of myeloid cells in the promotion of tumour angiogenesis. Nat. Rev. Cancer 8, 618–631 (2008).
- C. E. Lewis, A. S. Harney, J. W. Pollard, The multifaceted role of perivascular macrophages in tumors. Cancer Cell 30, 18–25 (2016).
- E. Fremder, M. Munster, A. Aharon, V. Miller, S. Gingis-Velitski, T. Voloshin, D. Alishekevitz, R. Bril, S. J. Scherer, D. Loven, B. Brenner, Y. Shaked, Tumor-derived microparticles induce bone marrow-derived cell mobilization and tumor homing: A process regulated by osteopontin. Int. J. Cancer 135, 270–281 (2014).
- C. L. Forse, S. Agarwal, D. Pinnaduwage, F. Gertler, J. S. Condeelis, J. Lin, X. Xue, K. Johung, A. M. Mulligan, T. E. Rohan, S. B. Bull, I. L. Andrulis, Menacalc, a quantitative method of metastasis assessment, as a prognostic marker for axillary node-negative breast cancer. BMC Cancer 15, 483 (2015).
- S. Agarwal, F. B. Gertler, M. Balsamo, J. S. Condeelis, R. L. Camp, X. Xue, J. Lin, T. E. Rohan, D. L. Rimm, Quantitative assessment of invasive mena isoforms (Menacalc) as an independent prognostic marker in breast cancer. Breast Cancer Res. 14, R124 (2012).
- M. J. Oudin, S. K. Hughes, N. Rohani, M. N. Moufarrej, J. G. Jones, J. S. Condeelis, D. A. Lauffenburger, F. B. Gertler, Characterization of the expression of the pro-metastatic MenaINV isoform during breast tumor progression. Clin. Exp. Metastasis 33, 249–261 (2016).
- G. Bonadonna, A. Moliterni, M. Zambetti, M. G. Daidone, S. Pilotti, L. Gianni, P. Valagussa, 30 years’ follow up of randomised studies of adjuvant CMF in operable breast cancer: Cohort study. BMJ 330, 217 (2005).
- G. Bonadonna, E. Brusamolino, P. Valagussa, A. Rossi, L. Brugnatelli, C. Brambilla, M. De Lena, G. Tancini, E. Bajetta, R. Musumeci, U. Veronesi, Combination chemotherapy as an adjuvant treatment in operable breast cancer. N. Engl. J. Med. 294, 405–410 (1976).
- J. M. Roodhart, M. H. Langenberg, J. S. Vermaat, M. P. Lolkema, A. Baars, R. H. Giles, E. O. Witteveen, E. E. Voest, Late release of circulating endothelial cells and endothelial progenitor cells after chemotherapy predicts response and survival in cancer patients. Neoplasia 12, 87–94 (2010).
- D. G. DeNardo, D. J. Brennan, E. Rexhepaj, B. Ruffell, S. L. Shiao, S. F. Madden, W. M. Gallagher, N. Wadhwani, S. D. Keil, S. A. Junaid, H. S. Rugo, E. S. Hwang, K. Jirström, B. L. West, L. M. Coussens, Leukocyte complexity predicts breast cancer survival and functionally regulates response to chemotherapy. Cancer Discov. 1, 54–67 (2011).
- C. Murdoch, S. Tazzyman, S. Webster, C. E. Lewis, Expression of Tie-2 by human monocytes and their responses to angiopoietin-2. J. Immunol. 178, 7405–7411 (2007).
- M. A. Venneri, M. De Palma, M. Ponzoni, F. Pucci, C. Scielzo, E. Zonari, R. Mazzieri, C. Doglioni, L. Naldini, Identification of proangiogenic TIE2-expressing monocytes (TEMs) in human peripheral blood and cancer. Blood 109, 5276–5285 (2007).
- M. De Palma, L. Naldini, Angiopoietin-2 TIEs up macrophages in tumor angiogenesis. Clin. Cancer Res. 17, 5226–5232 (2011).
- C. E. Lewis, A. S. Harney, J. W. Pollard, The multifaceted role of perivascular macrophages in tumors. Cancer Cell 30, 365 (2016).
- M. J. Oudin, L. Barbier, C. Schäfer, T. Kosciuk, M. A. Miller, S. Han, O. Jonas, D. A. Lauffenburger, F. B. Gertler, MENA confers resistance to paclitaxel in triple-negative breast cancer. Mol. Cancer Ther. 16, 143–155 (2017).
- S. K. Swisher, J. Vila, S. L. Tucker, I. Bedrosian, S. F. Shaitelman, J. K. Litton, B. D. Smith, A. S. Caudle, H. M. Kuerer, E. A. Mittendorf, Locoregional control according to breast cancer subtype and response to neoadjuvant chemotherapy in breast cancer patients undergoing breast-conserving therapy. Ann. Surg. Oncol. 23, 749–756 (2016).
- F. M. Blows, K. E. Driver, M. K. Schmidt, A. Broeks, F. E. van Leeuwen, J. Wesseling, M. C. Cheang, K. Gelmon, T. O. Nielsen, C. Blomqvist, P. Heikkilä, T. Heikkinen, H. Nevanlinna, L. A. Akslen, L. R. Bégin, W. D. Foulkes, F. J. Couch, X. Wang, V. Cafourek, J. E. Olson, L. Baglietto, G. G. Giles, G. Severi, C. A. McLean, M. C. Southey, E. Rakha, A. R. Green, I. O. Ellis, M. E. Sherman, J. Lissowska, W. F. Anderson, A. Cox, S. S. Cross, M. W. R. Reed, E. Provenzano, S.-J. Dawson, A. M. Dunning, M. Humphreys, D. F. Easton, M. García-Closas, C. Caldas, P. D. Pharoah, D. Huntsman, Subtyping of breast cancer by immunohistochemistry to investigate a relationship between subtype and short and long term survival: A collaborative analysis of data for 10,159 cases from 12 studies. PLOS Med. 7, e1000279 (2010).
- L. Zhang, S. Riethdorf, G. Wu, T. Wang, K. Yang, G. Peng, J. Liu, K. Pantel, Meta-analysis of the prognostic value of circulating tumor cells in breast cancer. Clin. Cancer Res. 18, 5701–5710 (2012).
- J.-Y. Pierga, F.-C. Bidard, C. Mathiot, E. Brain, S. Delaloge, S. Giachetti, P. de Cremoux, R. Salmon, A. Vincent-Salomon, M. Marty, Circulating tumor cell detection predicts early metastatic relapse after neoadjuvant chemotherapy in large operable and locally advanced breast cancer in a phase II randomized trial. Clin. Cancer Res. 14, 7004–7010 (2008).
- W. Onstenk, J. Kraan, B. Mostert, M. M. Timmermans, A. Charehbili, V. T. H. B. M. Smit, J. R. Kroep, J. W. R. Nortier, S. van de Ven, J. B. Heijns, L. W. Kessels, H. W. M. van Laarhoven, M. M. E. M. Bos, C. J. H. van de Velde, J. W. Gratama, A. M. Sieuwerts, J. W. M. Martens, J. A. Foekens, S. Sleijfer, Improved circulating tumor cell detection by a combined EpCAM and MCAM CellSearch enrichment approach in patients with breast cancer undergoing neoadjuvant chemotherapy. Mol. Cancer Ther. 14, 821–827 (2015).
- C. T. Guy, R. D. Cardiff, W. J. Muller, Induction of mammary tumors by expression of polyomavirus middle T oncogene: A transgenic mouse model for metastatic disease. Mol. Cell. Biol. 12, 954–961 (1992).
- F. Ahmed, J. Wyckoff, E. Y. Lin, W. Wang, Y. Wang, L. Hennighausen, J.-i. Miyazaki, J. Jones, J. W. Pollard, J. S. Condeelis, J. E. Segall, GFP expression in the mammary gland for imaging of mammary tumor cells in transgenic mice. Cancer Res. 62, 7166–7169 (2002).
- D. Entenberg, J. Wyckoff, B. Gligorijevic, E. T. Roussos, V. V. Verkhusha, J. W. Pollard, J. Condeelis, Setup and use of a two-laser multiphoton microscope for multichannel intravital fluorescence imaging. Nat. Protoc. 6, 1500–1520 (2011).
- D. Entenberg, D. Kedrin, J. Wyckoff, E. Sahai, J. Condeelis, J. E. Segall, Imaging tumor cell movement in vivo. Curr. Protoc. Cell Biol. Chapter 19, Unit 19.7 (2013).
- C. A. Schneider, W. S. Rasband, K. W. Eliceiri, NIH Image to ImageJ: 25 years of image analysis. Nat. Methods 9, 671–675 (2012).
- J. B. Wyckoff, J. G. Jones, J. S. Condeelis, J. E. Segall, A critical step in metastasis: In vivo analysis of intravasation at the primary tumor. Cancer Res. 60, 2504–2511 (2000).
- P. Thevenaz, U. E. Ruttimann, M. Unser, A pyramid approach to subpixel registration based on intensity. IEEE Trans. Image Process. 7, 27–41 (1998).
- P. J. Boimel, T. Smirnova, Z. N. Zhou, J. Wyckoff, H. Park, S. J. Coniglio, B.-Z. Qian, E. R. Stanley, D. Cox, J. W. Pollard, W. J. Muller, J. Condeelis, J. E. Segall, Contribution of CXCL12 secretion to invasion of breast cancer cells. Breast Cancer Res. 14, R23 (2012).
- H. Gil-Henn, A. Patsialou, Y. Wang, M. S. Warren, J. S. Condeelis, A. J. Koleske, Arg/Abl2 promotes invasion and attenuates proliferation of breast cancer in vivo. Oncogene 32, 2622–2630 (2013).
- T. D. Schmittgen, K. J. Livak, Analyzing real-time PCR data by the comparative CT method. Nat. Protoc. 3, 1101–1108 (2008).
- M. D. Weidmann, C. R. Surve, R. J. Eddy, X. Chen, F. B. Gertler, V. P. Sharma, J. S. Condeelis, MenaINV dysregulates cortactin phosphorylation to promote invadopodium maturation. Sci. Rep. 6, 36142 (2016).
Ursprünglicher Artikel >> https://www.science.org/doi/10.1126/scitranslmed.aan0026