![]()
Operationen bei Krebs: Auslöser für Metastasen
Samer Tohme, Richard L Simmons, and Allan Tsung
Einleitung
Mehr als ein Viertel aller Menschen auf der Welt erkranken irgendwann an Krebs (1), und die chirurgische Entfernung von Tumoren ist nach wie vor eine der wichtigsten Maßnahmen zur Heilung und Kontrolle der meisten soliden Krebsarten. Obwohl die chirurgische Entfernung von Primärtumoren oder sogar Metastasen lebensrettend oder lebensverlängernd sein kann, ist seit langem bekannt, dass der chirurgische Eingriff selbst das Wiederauftreten des Tumors beschleunigen oder beschleunigen kann. Der Gedanke, dass die Tumorentfernung das Wiederauftreten des Tumors begünstigen kann, wurde um die Wende zum 20. Jahrhundert von Paget und Halsted geäußert, die feststellten, dass Patienten, die sich einer Resektion ihres Krebses unterzogen, nicht so lange überlebten wie solche, bei denen eine Behandlung erwartet wurde (2). Solche Berichte wurden im Allgemeinen als anekdotisch abgetan, bis neuere Erkenntnisse zeigten, dass der chirurgische Eingriff ein günstiges Umfeld für das Tumorwachstum schaffen kann. Mehrere Gruppen haben vor kurzem die Idee wiederbelebt, dass die Auseinandersetzung mit den Mechanismen, die in der protumorigenen perioperativen Periode eine Rolle spielen, Einblicke in Möglichkeiten zur Verbesserung der Krebsresultate bieten könnte (3, 4).
Traumata und Entzündungen werden seit langem mit einem verstärkten Tumorwachstum in Verbindung gebracht, nachdem sie erstmals von Virchow beschrieben wurden (4). Die Neigung zirkulierender Tumorzellen in Versuchstieren zur Metastasierung an Orten physikalischer oder chemischer Verletzungen wurde Mitte des 20. Jahrhunderts wiederholt nachgewiesen (5). Das angeborene Immunsystem wird sowohl systemisch als auch lokal als Folge eines Gewebetraumas aktiviert und löst eine komplexe, vielschichtige Entzündungsreaktion aus. Natürlich ist eine solche Entzündung für die Beseitigung potenzieller Krankheitserreger und die Heilung des Gewebes von grundlegender Bedeutung, doch scheinen diese lokalen und systemischen entzündlichen Veränderungen einen fruchtbaren Boden für die Aufnahme von zirkulierenden Tumorzellen und deren anschließendes Wachstum zu bilden. In Tiermodellen wurde nachgewiesen, dass Verletzungsstellen ein bevorzugtes Gebiet für das Tumorwachstum sind und dass chirurgische Traumata die Bildung lokoregionaler Metastasen fördern (5). Mehrere experimentelle Studien belegen eindeutig, dass auf die Tumorentfernung ein beschleunigtes Tumorwachstum sowohl lokal als auch an entfernten Stellen folgt (4, 6). Darüber hinaus haben wir vor kurzem gezeigt, dass die Metastasenbelastung der Leber nach einer chirurgischen Belastung signifikant ansteigt, wobei die Operation sowohl zur Bildung neuer Metastasenherde als auch zur Beschleunigung des Tumorwachstums in der Region führte (7).
Trotz der überwältigenden Beweise aus experimentellen Studien waren klinische Studien nicht so überzeugend, und das Konzept ist immer noch umstritten, und die tatsächlichen Auswirkungen auf Krebspatienten bleiben unklar. Vieles beruht auf anekdotischen Belegen, die eine Beschleunigung des Wachstums von peritonealen Metastasen nach einer Laparotomie beschreiben (8). Darüber hinaus legen einige Studien den Schluss nahe, dass offene onkologische Resektionen im Vergleich zu minimalinvasiven Resektionen mit einem kürzeren krankheitsfreien Überleben verbunden sind, ein Konzept, das durch experimentelle Daten stark bestätigt wird (8). Auch hier sind die Befunde, dass unterschiedliche operative Ansätze die onkologischen Ergebnisse beeinflussen, ein deutlicher Hinweis darauf, dass das bei der Tumorentfernung verursachte Gewebetrauma das anschließende Wachstum der neoplastischen Resterkrankung beeinflussen kann.
In dieser Übersichtsarbeit werden wir kurz die zunehmenden Beweise zusammenfassen, die das Konzept unterstützen, dass eine chirurgische Entfernung des Krebses tatsächlich dazu dienen kann, die Bildung neuer Metastasen zu fördern und das Wachstum von Rest- und Mikrometastasen zu beschleunigen. Darüber hinaus werden wir die perioperativen Faktoren, die das postoperative Tumorwachstum fördern können, sowie die therapeutischen Implikationen, die diesem Phänomen entgegenwirken könnten, untersuchen (Abb. 1).
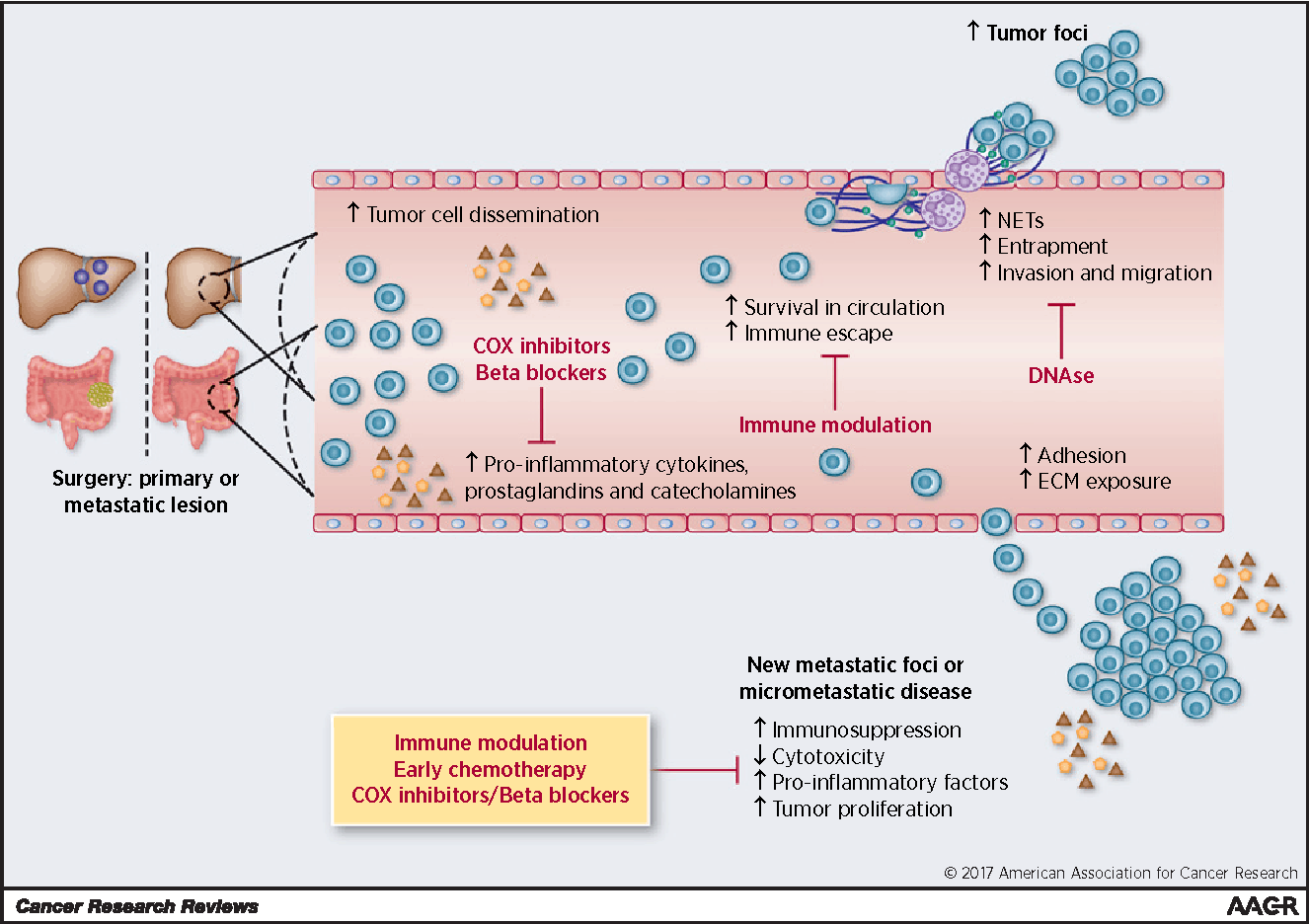
Auswirkungen der Tumorentfernung auf die Förderung von Metastasen. Zu diesen Effekten gehören ein beschleunigtes Wachstum von Mikrometastasen und die Bildung neuer Metastasenherde. Chirurgische Eingriffe steigern die Verbreitung von Tumorzellen, erhöhen die Überlebensrate zirkulierender Tumorzellen, indem sie die Umgehung des Immunsystems fördern, das Eindringen in den Metastasenherd verstärken und die Invasions- und Migrationsfähigkeit erhöhen, um neue Metastasenherde zu bilden. Auch chirurgische Eingriffe können Veränderungen in der Umgebung der mikrometastatischen Erkrankung bewirken und deren Wachstum fördern. Mehrere der in diesem Diagramm dargestellten therapeutischen Ansätze können in Betracht gezogen werden, um die protumorigenen entzündlichen Veränderungen in der perioperativen Phase anzugehen.
Chirurgie induziert die Bildung neuer metastatischer Erkrankungen
Damit eine Krebszelle erfolgreich in ein entferntes Organ metastasieren kann, muss eine komplexe Kaskade von Ereignissen ablaufen (9). Eine Krebszelle muss in den Blutkreislauf gelangen, die Abwehrmechanismen des Wirts überleben, sich an einem regionalen oder entfernten Ort festsetzen und schließlich in den neuen metastatischen Ort eindringen und dort gedeihen. Bei Patienten mit einer primären Krebserkrankung zirkulieren routinemäßig Tumorzellen. Die Metastasierung ist jedoch im Allgemeinen ein ineffizienter Prozess, und die meisten Krebszellen, die in den Blutkreislauf gelangen, werden schnell zerstört (9). Jedes Gewebetrauma, einschließlich der von Chirurgen durchgeführten sterilen Dissektion, löst jedoch eine Kaskade lokaler und systemischer zellulärer und humoraler Entzündungen aus, die das Potenzial haben, die Krebszelle einzufangen und ihr Überleben und metastatisches Wachstum zu fördern.
Die unvermeidliche Schädigung des Patientengewebes während der Exzision und der Manipulation des zu resezierenden Tumors und seines Gefäßsystems führt nachweislich zur Ablösung von Tumorzellen in den Blut- und Lymphkreislauf (10). Die Behandlung des Tumors kann zu einem mindestens 10-fachen Anstieg der zirkulierenden Tumorzellen führen (11). Außerdem hat sich gezeigt, dass die Menge der zirkulierenden Krebszellen vor und während der Operation ein starker Prädiktor für das Wiederauftreten des Tumors ist (12). Neben der Verbreitung der zirkulierenden Zellen tragen mehrere postoperative Veränderungen dazu bei, dass die Krebszellen im Blutkreislauf überleben und die Wahrscheinlichkeit einer Ferneinnistung erhöhen. Makrophagen und natürliche Killerzellen (NK) spielen eine entscheidende Rolle bei der Eliminierung zirkulierender Krebszellen und der Verhinderung der Metastasenbildung (13, 14). In experimentellen Modellen ging die Zunahme des Tumorwachstums nach einem chirurgischen Eingriff mit einer verminderten NK-Zytotoxizität und einer Beeinträchtigung der Makrophagenfunktion einher, die proportional zum Umfang und Ausmaß des chirurgischen Eingriffs war (13, 14).
Darüber hinaus stützt eine Reihe von Studien die Hypothese, dass die akute Entzündungsreaktion nach einer Operation die Aufnahme von Tumorzellen an fremden Orten begünstigt. So können beispielsweise proinflammatorische Zytokine wie IL1 und TNFa die Adhäsion lebensfähiger zirkulierender Krebszellen stimulieren (6). Chirurgische Eingriffe führen zu Veränderungen der Mesothelzellen in der Peritonealhöhle, die dazu führen, dass sie sich zurückziehen und ablösen, wodurch die darunter liegende extrazelluläre Matrix freigelegt wird, mit der die Krebszelle interagieren kann (15). Die Hemmung der Interaktionen zwischen Tumorzellen und ECM durch die Blockierung von a2-Integrinen führte bei Mäusen zu einer deutlichen Verringerung der chirurgisch induzierten Beschleunigung von Lebermetastasen (16).
Der Einstrom von Neutrophilen nach einem chirurgischen Trauma scheint die Aufnahme und das Wachstum von Tumoren weiter zu fördern (7). Neutrophile reagieren auf verletztes Gewebe, indem sie neutrophile extrazelluläre Fallen (NET) bilden, die aus extrazellulärer Extrusion von netzartiger DNA bestehen und zirkulierende Tumorzellen einfangen können. Zusätzlich zu ihrer mechanischen Funktion sind die DNA-Stränge mit einer Vielzahl entzündungsfördernder Moleküle besetzt, die für das Einfangen von Tumorzellen und das verstärkte Wachstum von Metastasen in chirurgisch manipulierten Lebern entscheidend sind (7). Die Hemmung von NETs nach der Operation hemmt die zuvor beobachtete beschleunigte Entwicklung neuer metastatischer Erkrankungen erheblich. Bei Menschen, die sich einer Resektion hepatischer kolorektaler Metastasen unterziehen, ist das Risiko eines erneuten Auftretens umso höher, je mehr NETs im Serum nachgewiesen werden (7). Somit stützen sowohl experimentelle als auch klinische Daten die Idee, dass die nach der Tumorentfernung entstandene Umgebung die langfristigen Ergebnisse der Krebsbehandlung beeinflussen kann.
Die Leber ist besonders anfällig für Metastasen aus primären gastrointestinalen soliden Tumoren. Einer der vielen möglichen Gründe dafür ist, dass ein chirurgisches Trauma die Integrität der Endothelzellen der Leber beeinträchtigen kann, was zu einer verminderten Expression von Tight-Junction-Proteinen führt und die Migration von Krebszellen in das Leberparenchym erleichtert (6). Darüber hinaus können die als Reaktion auf das chirurgische Trauma freigesetzten Katecholamine und Prostaglandine sowie die gebildeten NETs das metastatische Potenzial der anhaftenden zirkulierenden Krebszellen fördern, indem sie die Migration und Invasion von Tumorzellen in das entfernte Organ verstärken (3, 7). Das chirurgische Trauma synchronisiert somit die erhöhte Anzahl zirkulierender Krebszellen, die unterdrückte Antitumorimmunität und das prometastatische Umfeld der Zielorgane innerhalb der hepatischen gastrointestinalen Wasserscheide.
Perioperative Faktoren, die das Wiederauftreten von Krebs beeinflussen
Neben den bereits erwähnten Veränderungen, die direkt mit der chirurgischen Behandlung zusammenhängen, gibt es zahlreiche perioperative Variablen, die die onkologischen Ergebnisse verändern können. Dazu gehören Anästhesiemanagement, Bluttransfusion, Hypothermie und die Entwicklung postoperativer Komplikationen. Experimentelle Daten haben gezeigt, dass Anästhetika die Mikroumgebung und das Wachstum des Tumors direkt beeinflussen können (3). In ähnlicher Weise hat sich gezeigt, dass der Einsatz von Opioiden zur Schmerzbekämpfung bei Tieren und Menschen Stressreaktionen aktiviert, die zellvermittelte Immunität unterdrückt, die Angiogenese erhöht und das Fortschreiten von Metastasen fördert (3). Hinweise aus klinischen Beobachtungsstudien deuten darauf hin, dass sowohl die Vollnarkose als auch Opioid-Analgetika die Rezidivrate erhöhen (3), und wenn dies durch strengere Studien bestätigt wird, könnten Änderungen in der Anästhesie- und Schmerzbehandlung angezeigt sein.
Bluttransfusionen sind in der perioperativen Phase häufig erforderlich. Es wurde wiederholt gezeigt, dass Bluttransfusionen bei verschiedenen Krebsarten unabhängig voneinander mit einem signifikanten Anstieg der Sterblichkeit verbunden sind (3). Die Transfusion von Blutprodukten kann eine Immunsuppression, einen Anstieg der Prostaglandinproduktion und eine Unterdrückung der NK-Zellaktivität verursachen (3). Diese negativen Auswirkungen werden verstärkt, wenn mehr Einheiten transfundiert werden, wenn Vollblut statt gepackter roter Blutkörperchen verwendet wird und wenn Einheiten transfundiert werden, die länger gelagert wurden (3).
Trotz der Bemühungen, die Körpertemperatur während längerer Operationen aufrechtzuerhalten, kommt es häufig zu einer systemischen Hypothermie, und selbst eine perioperative Hypothermie von wenigen Grad kann immunsuppressive Folgen haben (21). Hypothermie kann auch zu Anomalien der Thrombozytenfunktion und der Gerinnungskaskade führen und damit möglicherweise den Bedarf an Bluttransfusionen erhöhen (22). In Nagetiermodellen führt Hypothermie zu einer signifikanten Zunahme des Tumorwachstums und ist außerdem mit einer unterdrückten NK-Funktion und einer erhöhten Anfälligkeit für die Entwicklung neuer metastatischer Erkrankungen verbunden.
Postoperative Infektionen bei Krebspatienten wurden mit ungünstigen onkologischen Ergebnissen in Verbindung gebracht, unabhängig von der mit dem infektiösen Insult verbundenen Morbidität (23). Dieses Phänomen wurde bei einer Vielzahl bösartiger Erkrankungen beobachtet, darunter Lungen-, Speiseröhren-, Brust-, Eierstock- und Darmkrebs; schwere postoperative infektiöse Komplikationen sind signifikant mit einer erhöhten Sterblichkeitsrate aufgrund von Metastasen verbunden (24). In Mausmodellen ist die Sepsis ein starker Stimulus für die Bildung von NETs, die die frühe Adhäsion von Tumorzellen an entfernten Organen fördern und das Fortschreiten der metastatischen Erkrankung erleichtern (25). Darüber hinaus können invasive postoperative Infektionen und die Translokation von Bakterien aus dem Magen-Darm-Trakt in den systemischen Kreislauf die Apoptose von Krebszellen verringern und die Resistenz gegen Chemotherapeutika erhöhen (8). LPS ist auch proangiogen und ein starker proinflammatorischer Mediator, der zum Tumorwachstum beitragen könnte (26).
Perioperative therapeutische Optionen
Es gibt eine Fülle von klinischen und experimentellen Daten, die das Konzept unterstützen, dass sich das Tumorwachstum in der unmittelbaren perioperativen Phase beschleunigen kann, was möglicherweise ein Zeitfenster bietet, in dem sich die onkologischen Ergebnisse verändern lassen. Die Verabreichung einer Chemotherapie unmittelbar nach der Operation ist bereits untersucht worden. Eine einzige kurze Dosis von Cyclophosphamid oder Anthrazyklinen, die in der postoperativen Phase verabreicht wurde, hat das Langzeitüberleben bei Brustkrebs signifikant verbessert (8, 27). Die unmittelbare postoperative Chemotherapie wurde jedoch aus Angst vor ihren negativen Auswirkungen auf die Infektionskontrolle und Wundheilung praktisch aufgegeben. Ähnlich wie bei der chirurgischen Tumorprogression können auch die Chemotherapie und andere Krebsbehandlungen selbst eine Kaskade von Wirtsereignissen auslösen, die das Wachstum und die Ausbreitung des Tumors fördern. Die oben genannte Problematik wurde von Ebos und Kollegen umfassend untersucht (28).
Abgesehen von der perioperativen Chemotherapie gibt es nur wenige Studien, die sich mit der positiven Beeinflussung des späteren Verlaufs von okkultem metastasiertem Krebs in der perioperativen Phase befassen. Neuroendokrine Mediatoren sind als Reaktion auf eine Operation deutlich erhöht und können die prometastatischen Fähigkeiten von Krebszellen direkt stimulieren und die zellvermittelte Immunität unterdrücken (3). Die Umkehrung der neuroendokrinen Reaktionen auf ein chirurgisches Trauma ist vielversprechend. Die Blockierung des Anstiegs von Katecholaminen und Prostaglandinen in der perioperativen Phase durch Betablocker oder COX-Hemmer könnte sich als nützlich erweisen. Es gibt einige wenige randomisierte kontrollierte Studien und retrospektive Kohortenstudien, die die Auswirkungen einer perioperativen Behandlung mit COX-Hemmern oder Betablockern untersucht haben, aber die Ergebnisse sind nicht schlüssig (3, 29).
Mehrere immunmodulatorische Ansätze, die an Tieren und/oder Menschen durchgeführt wurden, haben sich als vielversprechend erwiesen, um die chirurgisch bedingte Immunsuppression zu mildern und die Antitumor-Zytotoxizität in der perioperativen Phase wiederherzustellen. Dazu gehören die Verabreichung von IFNg, IL2, Granulozyten-Makrophagen-Kolonie-stimulierender Faktor und der Transfer von IL1-generierten Lymphokin-aktivierten Killerzellen (6). Auch Tumorimpfstoffe, wie z. B. DC-Vakzine, werden derzeit als mögliche Strategie für diesen Zeitraum untersucht (30). Durch die Bereitstellung einer adäquaten adaptiven Immunität gegen die zirkulierenden Tumoren und mikrometastatischen Erkrankungen könnten diese Strategien die durch die Operation verursachte Immunsuppression überwinden und die Behandlungsergebnisse möglicherweise verbessern. Ein weiterer vielversprechender Ansatz ergibt sich aus experimentellen Studien, die zeigen, dass die Blockierung der angeborenen Immunantwort, insbesondere der neutrophilen Granulozyten, an der Bildung von NETs durch die Verabreichung von DNAse die Bildung von Metastasen vermindern kann, vermutlich durch eine geringere Einlagerung von zirkulierenden Krebszellen an metastatischen Stellen (7, 25). Dies wird durch Humandaten unterstützt, die zeigen, dass eine erhöhte
NET-Bildung in der unmittelbaren postoperativen Phase mit einem signifikanten Anstieg des Wiederauftretens von Krebs einhergeht (7). Daher ist die Verwendung von DNAse zur Hemmung von NETs ein weiterer vielversprechender Ansatz für eine mögliche klinische Anwendung im perioperativen Bereich, und klinische Studien sind gerechtfertigt.
Die lokale und systemische Entzündungsreaktion auf eine Gewebeschädigung scheint vielen Aspekten des protumorigenen Ergebnisses bei potenziell kurativen chirurgischen Resektionen zugrunde zu liegen. Die Entzündung spiegelt eine koordinierte Reaktion von Chemokinen, Zytokinen und Entzündungszellen wider, die bereits vielfach untersucht wurde. Weniger erforscht ist das Abklingen der Entzündung, das ein aktiver und ebenso komplexer Prozess ist. Kürzlich wurden spezifische Mediatoren entdeckt, die für das Abklingen der Entzündung von Bedeutung sind und sich in der perioperativen Phase bei relativer Abwesenheit von mikrobiellen Krankheitserregern als nützlich erweisen könnten (31). Zu den Mediatoren gehören spezialisierte Lipidmoleküle wie Lipoxine, Resolvine, Protectine und Maresine, Proteine und Peptide der Annexin-A1-Familie, Prostaglandin E2 und Aktivatoren der PPAR-Familie der nuklearen Hormonrezeptoren (31). Mit unabhängigen und sich überschneidenden Mechanismen wirken diese Proresolutionsmediatoren zusammen, um proinflammatorische Substanzen aus Thrombozyten, Neutrophilen und Makrophagen herunterzuregulieren, was zu einem phänotypischen Wechsel hin zu einer homöostatischen Normalität führt. Eine pharmakologische Beeinflussung dieser Pro-Resolution-Mechanismen könnte sich bei der Umkehrung der prometastatischen Tendenzen in der perioperativen Phase als nützlich erweisen.
Was die Beeinflussung perioperativer klinischer Faktoren betrifft, so könnte es angesichts der oben genannten experimentellen und klinischen Erkenntnisse vorteilhafter sein, bei onkologischen Resektionen Regionalanästhesie und nichtopioide Analgetika einzusetzen. Auch die Reduzierung von Bluttransfusionen, die Vermeidung von Vollbluttransfusionen, die Verwendung von Einheiten mit kürzerer Haltbarkeit und die Aufrechterhaltung der Normothermie während der Operation und der unmittelbaren postoperativen Phase können die damit verbundene Immunsuppression verhindern, die sich negativ auf die onkologischen Ergebnisse auswirken kann. Interessanterweise kann die Einbeziehung der zunehmend eingeführten ERAS-Pfade (Enhanced Recovery After Surgery), wenn dies möglich ist, onkologische Vorteile bringen, da sich viele der ERAS-Leitlinien mit den oben genannten Grundsätzen überschneiden (32). Es hat sich auch gezeigt, dass ERAS-Pfade postoperative Komplikationen deutlich verringern und somit das Potenzial haben, die langfristigen onkologischen Ergebnisse zu verbessern, auch wenn dies noch nicht untersucht wurde.
Schlussbemerkungen
Metastasierung ist eine häufige Ursache für Morbidität und Mortalität bei Krebspatienten. Sowohl experimentelle als auch klinische Belege sprechen dafür, dass eine Operation, die als kurative Option zur Entfernung und Verkleinerung der Tumormasse gedacht ist, paradoxerweise auch die Entstehung von Metastasen begünstigen kann. Wenn es gelingt, die Faktoren in der perioperativen Phase zu beseitigen, die die Bildung von Metastasen begünstigen, könnte die unmittelbare postoperative Phase ein einzigartiges Fenster zur Kontrolle der verbleibenden bösartigen Zellen werden.
Offenlegung potenzieller Interessenkonflikte
Es wurden keine potenziellen Interessenkonflikte offengelegt.
Haftungsausschluss
Der Inhalt liegt in der alleinigen Verantwortung der Autoren und gibt nicht unbedingt die offiziellen Ansichten der NIH wieder.
Finanzielle Unterstützung
S. Tohme wurde von den NIH unterstützt (T32CA113263).
Eingereicht am 31. Mai 2016; überarbeitet am 3. Dezember 2016; angenommen am 7. Dezember,
2016; veröffentlicht OnlineFirst 22. März 2017
Referenzen
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin 2015;65:5–29.
- Halsted WS. I. The results of radical operations for the cure of carcinoma of the breast. Ann Surg 1907;46:1–19.
- Horowitz M, Neeman E, Sharon E, Ben-Eliyahu S. Exploiting the critical perioperative period to improve long-term cancer outcomes. Nat Rev Clin Oncol 2015;12:213–26.
- Demicheli R, RetskyMW, HrusheskyWJ, BaumM, Gukas ID. The effects of surgery on tumor growth: a century of investigations. Ann Oncol 2008;19:1821–8.
- Murthy SM, Goldschmidt RA, Rao LN, Ammirati M, Buchmann T, Scanlon EF. The influence of surgical trauma on experimental metastasis. Cancer 1989;64:2035–44.
- van der Bij GJ, Oosterling SJ, Beelen RH, Meijer S, Coffey JC, van Egmond M. The perioperative period is an underutilized window of therapeutic opportunity in patients with colorectal cancer. Ann Surg 2009;249:727–34.
- Tohme S, Yazdani HO, Al-Khafaji AB, Chidi AP, Lougharn P, Mowen K, et al. Neutrophil extracellular traps promote the development and progression of liver metastases after surgical stress. Cancer Res 2016;76: 1367–80.
- Coffey JC,SmithMJ,Wang JH, Bouchier-HayesD,Cotter TG, RedmondHP. Cancer surgery: risks and opportunities. BioEssays 2006;28:433–7.
- Chambers AF, Groom AC, MacDonald IC. Dissemination and growth of cancer cells in metastatic sites. Nat Rev Cancer 2002;2:563–72.
- Yamaguchi K, Takagi Y, Aoki S, FutamuraM, Saji S. Significant detection of circulating cancer cells in the blood by reverse transcriptase-polymerase chain reaction during colorectal cancer resection. Ann Surg 2000;232: 58–65.
- Liotta LA, Kleinerman J, Saidel GM. Quantitative relationships of intravascular tumor cells, tumor vessels, and pulmonary metastases following tumor implantation. Cancer Res 1974;34:997–1004.
- Koch M, Kienle P, Hinz U, Antolovic D, Schmidt J, Herfarth C, et al. Detection of hematogenous tumor cell dissemination predicts tumor relapse in patients undergoing surgical resection of colorectal liver metastases. Ann Surg 2005;241:199–205.
- Rushfeldt C, Sveinbjornsson B, Seljelid R, Smedsrod B. Early events of hepatic metastasis formation in mice: role of Kupffer and NK-cells in natural and interferon-gamma-stimulated defense. J Surg Res 1999;82: 209–15.
- Oosterling SJ, van der Bij GJ, Meijer GA, Tuk CW, van Garderen E, van Rooijen N, et al. Macrophages direct tumour histology and clinical outcome in a colon cancer model. J Pathol 2005;207:147–55.
- Oosterling SJ, van der Bij GJ, Bogels M, ten Raa S, Post JA, Meijer GA, et al. Anti-beta1 integrin antibody reduces surgery-induced adhesion of colon carcinoma cells to traumatized peritoneal surfaces. Ann Surg 2008;247: 85–94.
- van der BijGJ, Oosterling SJ, Bogels M, Bhoelan F, Fluitsma DM, Beelen RH, et al. Blocking alpha2 integrins on rat CC531s colon carcinoma cells prevents operation-induced augmentation of liver metastases outgrowth. Hepatology 2008;47:532–43.
- Michelson S, Leith JT. Dormancy, regression, and recurrence: towards a unifying theory of tumor growth control. J Theor Biol 1994;169:327–38.
- Chiarella P, Bruzzo J, Meiss RP, Ruggiero RA. Concomitant tumor resistance. Cancer Lett 2012;324:133–41.
- Berguer R, Bravo N, Bowyer M, Egan C, Knolmayer T, Ferrick D. Major surgery suppresses maximal production of helper T-cell type 1 cytokines without potentiating the release of helper T-cell type 2 cytokines. Arch Surg 1999;134:540–4.
- Da Costa ML, Redmond P, Bouchier-Hayes DJ. The effect of laparotomy and laparoscopy on the establishment of spontaneous tumor metastases. Surgery 1998;124:516–25.
- Kurz A, Sessler DI, Lenhardt R. Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization. Study of Wound Infection and Temperature Group. N Engl J Med 1996; 334:1209–15.
- Frank SM, Higgins MS, Breslow MJ, Fleisher LA, Gorman RB, Sitzmann JV, et al. The catecholamine, cortisol, and hemodynamic responses to mild perioperative hypothermia. A randomized clinical trial. Anesthesiology 1995;82:83–93.
- Ohtsuka T, Kitajima Y, Takahashi T, Sato S, Miyoshi A, Kohya N, et al. Infectious complications after gastric cancer surgery accelerate a rapid hepatic recurrence. Hepato-gastroenterology 2009;56:1277–80.
- Colotta F, Allavena P, Sica A, Garlanda C, Mantovani A. Cancer-related inflammation, the seventh hallmark of cancer: links to genetic instability. Carcinogenesis 2009;30:1073–81.
- Cools-Lartigue J, Spicer J,McDonald B,Gowing S,ChowS,Giannias B, et al. Neutrophil extracellular traps sequester circulating tumor cells and promote metastasis. J Clin Invest 2013 Jul 1. [Epub ahead of print].
- Mattsby-Baltzer I, Jakobsson A, Sorbo J, Norrby K. Endotoxin is angiogenic. Int J Exp Pathol 1994;75:191–6.
- van der Hage JA, van de Velde CJ, Julien JP, Floiras JL, Delozier T, Vandervelden C, et al. Improved survival after one course of perioperative chemotherapy in early breast cancer patients. long-term results from the European Organization for Research and Treatment of Cancer (EORTC) Trial 10854. Eur J Cancer 2001;37:2184–93.
- Ebos JM. Prodding the beast: assessing the impact of treatment-induced metastasis. Cancer Res 2015;75:3427–35.
- Neeman E, Zmora O, Ben-Eliyahu S. A new approach to reducing postsurgical cancer recurrence: perioperative targeting of catecholamines and prostaglandins. Clin Cancer Res 2012;18:4895–902.
- Mosolits S, Ullenhag G, Mellstedt H. Therapeutic vaccination in patients with gastrointestinalmalignancies. A reviewof immunological and clinical results. Ann Oncol 2005;16:847–62.
- Headland SE, Norling LV. The resolution of inflammation: Principles and challenges. Semin Immunol 2015;27:149–60.
- Varadhan KK, LoboDN, LjungqvistO. Enhanced recovery after surgery: the future of improving surgical care. Crit Care Clin 2010;26:527–47. 1552